Muskelkontraktion
| Übergeordnet |
| Systemischer Prozess im Muskel |
| Untergeordnet |
| Kontraktion der glatten Muskulatur
Kontraktion der quergestreiften Muskulatur |
| Gene Ontology |
|---|
| QuickGO |
Eine Muskelkontraktion ist die aktive Muskelverkürzung (konzentrische Kontraktion).[1] Auch den Muskelkontraktionen zugerechnet werden Anspannungen des Muskels, die keine Verkürzung bewirken, sondern den Muskel gegen Widerstand in einer bestimmten Länge halten (isometrische Kontraktion), und solche, die einer auf den Muskel wirkenden Kraft einen Widerstand entgegensetzen, während er verlängert wird (exzentrische Kontraktion).
Grundlagen
[Bearbeiten | Quelltext bearbeiten]
Dabei handelt es sich allgemein um einen biologischen Prozess, bei dem mechanische Kräfte im Muskelgewebe erzeugt werden. Im Falle der Skelettmuskeln werden diese Kräfte durch Sehnen auf die Knochen übertragen.
Die Kräfte entstehen durch Umwandlung von chemischer in mechanische Energie mittels des Aktin-Myosin-Komplexes in den einzelnen Muskelzellen. Die Muskelleistung wiederum bezieht ihre chemische Energie aus der Hydrolyse von ATP.
Um also eine Kontraktion des Muskels als ganzem Gewebeteil und die Übertragung der dabei erzeugten Kraft zu gewährleisten, bedarf es einer Synchronisation und Koordination der Kontraktion der Muskel(faser)zellen und einer Übertragung der durch jede einzelne Muskelfaser erzeugten Kraft auf die betreffende Sehne.
Ein Muskel ist ein Teil des Gewebes in den meisten vielzelligen Tieren, das als Ganzes beweglich meist einem Knochen oder anderen Muskeln aufliegt (Verschiebbarkeit durch Schichten von lockerem Bindegewebe, Faszien und Logen) und durch seine Verbindungen mit Sehnen in der Lage ist, Gliedmaßen, innere Körperbezirke (Bauchpresse beim Husten, Miktion, Defäkation, Geburtsvorgang usw.; Atmungsbewegung) zu bewegen und damit letztlich dem Individuum ermöglicht, Kräfte auf seine Umwelt auszuüben (z. B. einen Nagel in die Wand schlagen) und sich selbst fortzubewegen.
Muskelkontraktion im Kontext des Bewegungsapparates der Extremitäten
[Bearbeiten | Quelltext bearbeiten]Um eine Bewegung von Körperteilen gegen Widerstand, z. B. das Anheben eines Beines, welches ein erhebliches Eigengewicht aufweist, oder gar das Abbremsen aus dem Lauf oder Sprung zu ermöglichen, muss der Muskel über den Sehnenapparat Kraft auf die Angriffspunkte an den Knochen ausüben können. Hierzu ist ein durchgängiger Kraftschluss erforderlich, der alle Teile der Sehnen und des Muskels einbeziehen muss.
Dieser Kraftschluss muss nach dem Prinzip „Die Kette ist so stark wie ihr schwächstes Glied“ sämtliche Elemente sowohl der Grob- als auch der Feinstruktur des Muskelaufbaus umfassen. Dies beinhaltet also verschiedene Ebenen: den Muskel als ganzen Gewebeteil, die Muskelfaser, die Myofibrille und in longitudinaler Gliederung das Sarkomer als kleinsten Abschnitt der Myofibrille. An den Übergängen Muskelfaser/Muskelfaser (Endomysium), Fibrille/Fibrille, Endomysium/Sehne, Perimysium/Sehne usw. bis zu den Übergängen der Sarkomere innerhalb der Fibrille müssen die Strukturen die auftretenden Kräfte kontrollieren und teilweise umleiten (Scherkräfte) können. Die Muskelfasern können pro cm² Muskelquerschnitt eine Kraft von bis zu 40 N aufbringen und sind passiv bis zu 100 N/cm² belastbar.[2]
Auffällig ist, dass von den die Sehnenkräfte übertragenden Strukturen insbesondere das Endomysium zur Übertragung beiträgt, indem es direkt mit den einstrahlenden Sehnenenden verbunden ist. Da das Endomysium über Myotendinöse Verbindungen die auf die Enden der Aktinfilamente (s. u.) ausgeübten Kräfte direkt aufnimmt, ist der Kraftschluss hier gewährleistet.
Neben der Kraftübertragung in Richtung der Kontraktion ist die Verhinderung bzw. Umleitung von Scherkräften eine wichtige Aufgabe, die der Muskel durch Mechanismen der mechanischen Verbindung, aber auch der Steuerung der Kontraktion der Muskelfaserzellen erfüllt. Hier kommen den transversalen Strukturen, die den Zusammenhalt der Fibrillen zu Fasern und wiederum der Fasern zu Muskelsträngen gewährleisten, große Bedeutung zu. In mechanischer Hinsicht sind hier die Costamere und die Desmin-Filamente zu nennen, in Hinsicht auf die Steuerung und damit Reduzierung von Scherkräften die Synchronisation der Arbeit der Sarkomere und damit der Fibrillen durch die schnelle Weiterleitung des von den Endplatten erzeugten Aktionspotentials in longitudinaler und transversaler Richtung über die sog. Triaden. Hierbei handelt es sich um eine die Fibrillen umfassende, transversale Struktur aus je zwei endständigen Zisternen des Sarkoplasmatischen Retikulums und einem transversalen Tubulus, der morphologisch eine Einstülpung der Plasmamembran darstellt und das Aktionspotential sowohl in der Länge als auch in die Tiefe überträgt. Dort sorgt er für die Öffnung spezifischer Ca-Kationen-Kanäle, was die Auslösung des kontraktilen Mechanismus bewirkt.
Beschreibung des Kontraktionsmechanismus
[Bearbeiten | Quelltext bearbeiten]Filamentgleittheorie, Querbrückenzyklus und seine Phasen
[Bearbeiten | Quelltext bearbeiten]
Nach der Gleitfilament- beziehungsweise Filamentgleittheorie von Andrew F. Huxley und Hugh E. Huxley[3] gleiten bei der Kontraktion Filamentproteine ohne Veränderung der Eigenlänge ineinander und verkürzen somit die Länge des Muskels. Bei den Filamentproteinen handelt es sich um Aktin, das äußere, dünne Filament, und Myosin, das innere, dicke Filament, welches sich am dünnen Filament vorbeischiebt und dadurch die Kontraktion ermöglicht. Diese Bewegung wird durch Änderungen der chemischen Konfiguration und damit der Form der Myosin-Moleküle ermöglicht: Das Myosin besitzt kleine Fortsätze („Köpfe“), die ihren Winkel zum Rest des Moleküls („Schaft“) verändern können. Die Köpfe können wiederum an die Aktin-Filamente binden und diese in sogenannten „Ruderbewegungen“ verschieben. Ausgelöst wird die Kontraktion durch einen Nervenimpuls. Zudem wird für die Lösung des Myosins vom Aktin Energie in Form von ATP benötigt. Steht diese nicht mehr zur Verfügung, können sich die Moleküle nicht mehr voneinander lösen und es kommt zur Totenstarre.
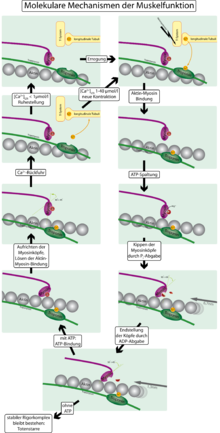
Im Detail wird die Kontraktion durch den so genannten Querbrückenzyklus (Greif-Loslass-Zyklus) zwischen den Aktin- und Myosinfilamenten erklärt. Der Name rührt von der Funktion der Myosinköpfe als Querbrücken zwischen den Aktin- und Myosin-Filamenten her.
- Im Ruhezustand (entspannter Muskel) ist das Aktinfilament mit so genannten Tropomyosinfäden umschlungen, die die Bindungsstellen der Myosinköpfchen an dem Aktinfilament bedecken. An das Myosin ist ATP gebunden, das Köpfchen befindet sich in einem 90-Grad-Winkel zum Schaft des Moleküls.
- Ein Nervenimpuls von der motorischen Endplatte bewirkt die Ausschüttung von Calcium (Ca2+). Das hat zwei Folgen: Zum einen aktiviert Ca2+ die Enzymtätigkeit des Myosinköpfchens, welche der einer ATPase gleichzusetzen ist, sodass das angelagerte ATP in ADP (Adenosindiphosphat) und Pi (Phosphatrest) gespalten wird. Die ATPase benötigt Mg2+ als Cofaktor für die Spaltung. Das Calcium bindet zum anderen an Troponin, das an den Tropomyosinfäden angelagert ist, und verändert dabei deren Konfiguration so, dass die Bindungsstellen freigegeben werden und das Myosin an das Aktin binden kann. Für diese Anlagerung wird vermutlich keine (ATP-)Energie benötigt.
- Sobald das Myosin an das Aktin gebunden hat, wird das immer noch am Myosinköpfchen anliegende Pi und kurz danach auch das ADP freigesetzt. Dadurch wird die Verspannung des Myosins in mechanische Energie umgesetzt: Die Myosinköpfchen kippen in einem 45 Grad-Winkel zum Myosinfilament (ähnlich einem Ruderschlag, auch als Kraftschlag bezeichnet[4]) und ziehen dabei die Aktinfilamente von rechts und links zur Sarkomermitte.
- Der Zyklus wird dadurch abgeschlossen, dass sich neues ATP an das Myosin anlagert. Dadurch löst sich das Myosinköpfchen vom Aktinfilament und die beiden Proteine befinden sich wieder im Ausgangszustand.
Ein Querbrücken-Zyklus dauert 10–100 ms und verschiebt die Filamente um 10–20 nm, was nur etwa einem Prozent ihrer Länge entspricht. Um eine größere Längenveränderung zu ermöglichen, muss der Zyklus daher mehrere Male durchlaufen werden. Durch etwa 50 Greif-Loslass-Zyklen kann sich das Sarkomer in deutlich weniger als einer Sekunde um ca. 50 % seiner Ruhelage verkürzen.
Sinkt die Ca2+-Konzentration unter 10−7 mol/l, schlingen sich die Tropomyosinfäden wieder um das Aktinfilament, so dass sich keine neuen Bindungen mit den Myosinköpfchen bilden können – der Muskel erschlafft, man spricht dann von Muskelrelaxation. Dazu ist es nötig, das Calcium durch aktive Ionenpumpen aus dem Muskelgewebe zu transportieren. Die Beteiligung von Calcium-Ionen an der Muskelkontraktion wurde erstmals durch Setsuro Ebashi nachgewiesen.
Einige der Details der Gleitfilamenttheorie sind noch nicht abschließend geklärt. So ist etwa die genaue geometrische Konfiguration der Myosin-Köpfchen Gegenstand aktueller Forschung.[5][6]
Kontraktionsarten
[Bearbeiten | Quelltext bearbeiten]- isotonisch („gleichgespannt“) Der Muskel verkürzt sich ohne Kraftänderung. Beispielsweise wenn ein Gewicht oder Gegenstand sehr langsam um eine kurze Strecke angehoben wird.
- isometrisch („gleichen Maßes“) Die Kraft erhöht sich bei gleicher Länge des Muskels (haltend-statisch). Im physikalischen Sinne wird keine Arbeit geleistet, da der zurückgelegte Weg gleich null ist. Beispielsweise Ziehen an einer verschlossenen Tür oder versuchtes Heben eines „zu schweren“ Gewichtes.
- auxotonisch („verschiedengespannt“) Sowohl Kraft als auch Länge ändern sich. Das ist der häufigste Kontraktionstyp.
Aus diesen elementaren Arten der Kontraktion lassen sich komplexere Kontraktionsformen zusammensetzen. Sie werden im alltäglichen Leben am häufigsten benutzt. Das sind z. B.
- die Unterstützungskontraktion
- erst isometrische, anschließend isotone bzw. auxotonische Kontraktion Beispiel: Anheben eines Gewichtes vom Boden und anschließendes Anwinkeln des Unterarms.
- die Anschlagskontraktion
- Nach einer auxotonischen oder isotonischen Kontraktion wird der Muskel durch einen Anschlag (Arretierung) fixiert. Jetzt kann sich nur noch die Spannung im Muskel isometrisch erhöhen. Erst isotonische, dann isometrische Kontraktion. Beispiel: Boxen am Boxsack, Kaubewegung, Ohrfeige.
Hinsichtlich der resultierenden Längenänderung des Muskels und der Geschwindigkeit, mit der diese erfolgt, lassen sich Kontraktionen z. B. folgendermaßen charakterisieren:
- isokinetisch („gleich schnell“)
- Der Widerstand wird mit einer gleich bleibenden Geschwindigkeit überwunden.
- konzentrisch
- der Muskel überwindet den Widerstand und wird dadurch kürzer (positiv-dynamisch, überwindend). Dabei ändert sich die intramuskuläre Spannung.
- exzentrisch
- hier ist der Widerstand größer als die Spannung im Muskel, dadurch wird der Muskel verlängert (negativ-dynamisch, nachgebend); der Muskel „bremst“ dabei eine Bewegung ab, er wirkt fallverhindernd. Es kommt zu Spannungsänderungen und Verlängerung/Dehnung der Muskeln. Diese Form der Belastung bzw. Kontraktion tritt zum Beispiel beim Bergabgehen in der vorderen Oberschenkelmuskulatur (M. quadriceps femoris) auf.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- R. Klinke und S. Silbernagl (Hrsg.): Lehrbuch der Physiologie. 4. Auflage, Thieme-Verlag 2003, ISBN 3-13-796004-5
- G. Löffler: Basiswissen Biochemie. 4. Auflage, Springer-Verlag 2001, ISBN 3-540-67389-X.
- M. A. Geeves and K.C. Holmes (1999): Structural Mechanism of Muscle Contraction. Annual Review of Biochemistry 68:687–728.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Kontraktionsanimation (englisch)
- Kontraktionsabfolge
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Benninghoff/Drenckhahn (Hrsg.): Anatomie, Band 1: Makroskopische Anatomie, Histologie, Embryologie, Zellbiologie; München, Jena (Urban & Fischer) 2003 (16. Auflage), S. 149.
- ↑ Benninghoff/Drenckhahn (Hrsg.): Anatomie, Band 1: Makroskopische Anatomie, Histologie, Embryologie, Zellbiologie; München, Jena (Urban & Fischer) 2003 (16. Auflage), S. 149ff.
- ↑ Hugh Huxley und Jean Hanson: Changes in the Cross-Striations of Muscle during Contraction and Stretch and their Structural Interpretation. In: Nature. Band 173, 1954, S. 973–976, doi:10.1038/173973a0
A. F. Huxley und R. Niedergerke: Structural Changes in Muscle During Contraction: Interference Microscopy of Living Muscle Fibres. In: Nature. Band 173, 1954, S. 971–973, doi:10.1038/173971a0.
vergl. dazu auch K. Maruyama (1995): Birth of the Sliding Filament Concept in Muscle Contraction. In: J Biochem. Band 117 (1): 1–6. - ↑ J. M. Berg, J. L. Tymoczko, L. Stryer: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Elsevier GmbH, München 2007; S. 1107f., ISBN 978-3-8274-1800-5.
- ↑ H. L. Sweeney and A. Houdusse (2010): Structural and Functional Insights into the Myosin Motor Mechanism. Annual Review of Biophysics 39: 539–557.
- ↑ Behrmann et al. (2009): Structure of the Rigor Actin-Tropomyosin-Myosin Complex. Cell 150:327–338.