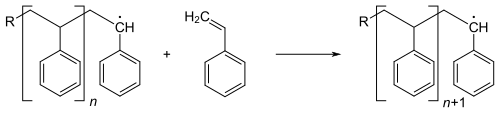
Radikalische Polymerisation mit reversibler Deaktivierung
Radikalische Polymerisation mit reversibler Deaktivierung (aus dem Engl.: Reversible-deactivation radical polymerization, kurz RDRP, oder auch Controlled reversible-deactivation radical polymerization) ist nach IUPAC eine Sammelbezeichnung für Kettenpolymerisationen die durch Radikale propagieren, wobei die Radikale reversibel deaktiviert werden und sich aktiv-ruhende Gleichgewichte einstellen.[1] Von den aktiv-ruhenden Gleichgewichten kann es bei einer Polymerisation mehrere geben. RDRP zählen nach IUPAC zu der Klasse der Polymerisationen mit reversibler Deaktivierung (aus dem Engl.: reversible-deactivation polymerization (RDP)).
Die IUPAC wertet den verkürzten Namen Kontrollierte radikalische Polymerisation als akzeptabel, wenn die besonderen kontrollierten kinetischen Merkmale der Reaktion oder die strukturellen Merkmale des Polymers unmittelbar beschrieben werden. Die Bezeichnung wurde von der IUPAC noch 2009 als Sammelbezeichnung empfohlen[2] und wird in deutschsprachigen Lehrbüchern bevorzugt verwendet.
RDRP hat Ähnlichkeiten mit lebenden Polymerisationen. Für lebende Polymerisationen wird jedoch die Abwesenheit von Abbruch- und Kettenübertragungsreaktion verlangt.[3] RDRP soll daher nicht als „lebend“ bezeichnet werden, da sie nicht frei von ihnen verlaufen. Damit wird von Formulierungen wie lebende radikalische Polymerisation, quasi-lebende Polymerisation oder kontrollierte/lebende Polymerisation abgeraten.[1]
Konventionelle und Kontrollierte radikalische Polymerisation
[Bearbeiten | Quelltext bearbeiten]Die konventionelle radikalische Polymerisation – manchmal fälschlicherweise als freie radikalische Polymerisation bezeichnet[Anm. 1] – ist einer der am weitesten verbreiteten Reaktionstypen der Polymerisationen. Sie ist für viele ungesättigte Monomeren geeignet, die auch zusätzliche funktionelle Gruppen tragen können, ohne die Polymerisation zu behindern. Die technischen Prozesse können kontinuierlich oder als Chargenprozess geführt werden. Diverse Polymerisationsverfahren wie beispielsweise die Emulsionspolymerisation oder Suspensionspolymerisation ist etabliert.
Bei der konventionelle radikalische Polymerisation stellt sich ein weitgehend stationärer Zustand der Konzentration der wachsenden Polymerketten ein[4][Anm. 2], der in der Größenordnung von 10−7 mol/l liegt. Die durchschnittliche Lebensdauer einer wachsenden Kette bis zur Abbruchreaktion liegt bei etwa 5–10 s und ist damit viel kürzer als die Prozessdauer. Neue Polymere bilden sich durch den Zerfall des Initiartors über den gesamten Prozess. Ein Nachteil konventionellen Polymerisation ist die begrenzte Kontrolle der Kettenarchitektur, der Zusammensetzung der Makromoleküle und der Molekulargewichtsverteilung. Bei der Herstellung von Copolymeren bilden sich statistische Copolymere. Die sehr breite Molekulargewichtsverteilung entspricht etwa einer Schulz-Flory-Verteilung.
Die Entwicklung der Radikalische Polymerisation mit reversibler Deaktivierung setzte Ende des 20. Jahrhunderts ein. Man fand Stoffe, die in der Lage sind mit wachsenden Polymerketten zu reagieren und sie in einer Gleichgewichtsreaktion in einen „schlafenden“ Zustand zu versetzen. Liegt das Gleichgewicht auf der Seite des „schlafenden“ Zustands und ist die Gleichgewichtsreaktion schneller als die Wachstumsrate, ist nur ein sehr kleiner Teil der potentiell wachsenden Ketten aktiv und kann kurzzeitig etwas wachsen, bevor die aktive Kettenenden wieder in den inaktiven (ruhenden) Zustand übergehen. Der Initiator zerfällt weitgehend in der ersten Phase der Polymerisation. Damit wird Lebensdauer der (potentiell) wachsenden Polymerketten auf Werte verlängert, die mit der Dauer des Syntheseprozesses vergleichbar ist. Im Durchschnitt wachsen alle Ketten mit der gleichen Geschwindigkeit, da alle die gleiche Wachstumswahrscheinlichkeit haben. Folglich nehmen die Molekülmassen (Polymerisationsgrade) statt einer höchst wahrscheinlichen Verteilung eine viel engere Poisson-Verteilung an und es liegt eine geringere Dispersität vor. Nur Chargenprozesse sind zweckmäßig, da sich sonst Schulz-Flory-Verteilungen bilden.[5] Sind die Monomere verbraucht, können Comonomere hinzugefügt werden und es bilden sich Blockcopolymere. Eine ähnliche Steuerung des Polymerisationsgrades und die Herstellung von Blockcopolymeren lassen auch lebende Polymerisationen zu. Dabei handelt es sich meist um anionische Polymerisationen.[6]
Vergleich
[Bearbeiten | Quelltext bearbeiten]| Vergleich von Polymerisationen | |||
| Konventionelle radikalische Polymerisation | Lebende Polymerisation | Radikalische Polymerisation mit reversibler Deaktivierung | |
| Konzentration der Initiatoren über die Prozessdauer | Fällt nur langsam ab | Fällt sehr schnell ab | Fällt sehr schnell ab |
| Konzentration wachsender Ketten über die Prozessdauer | stationärer Zustand, (Bodenstein'sches Quasistationaritätsprinzip)[7][8] |
Konstant über die Reaktion | Konstant über die Reaktion |
| Lebensdauer einer wachsenden Kette | wenige Sekunden | über die Prozessdauer hinaus | entspricht etwa der Prozessdauer |
| Abbruchreaktionen einer wachsenden Kette | Kettenwachstum endet immer durch eine Abbruch- oder Kettenübertragungsreaktion. | Abbruch- oder Kettenübertragungsreaktionen treten nicht auf. | Radikale werden reversibel deaktiviert. Abbruch- oder Kettenübertragungsreaktionen treten über die Prozessdauer vergleichsweise selten auf. |
| Molmassenverteilung | breite Verteilung: Schulz-Flory- oder Schulz-Zimm-Verteilung[Anm. 3] | enge Verteilung: Poisson-Verteilung | enge Verteilung: Poisson-Verteilung |
| Polydispersität Ð | ≤ 2 bis 1,5 | ≥ 1 bis 1,5 | ≥ 1 bis 1,5 |
| ruhender Zustand | kein | kein | vorherrschend |


Schulz-Flory-Verteilung und Poisson-Verteilung im Vergleich: Gewichtsbruchverteilung wp über den Polymerisationsgrad i, beide bei einer mittleren kinetischen Kettenlänge von 50. Polydispersität: 1,98 (Schulz-Flory-Verteilung) und 1,02 (Poisson-Verteilung).[9] Poisson-Verteilungen: Gewichtsbruchverteilung wp über den Polymerisationsgrad i bei mittleren kinetischen Kettenlängen von 50, 100 und 200. Die Polydispersität liegt bei 1,020 (50), 1,010 (100) und 1,005 (200).[9] Auffällig ist die zunehmende Halbwertsbreite der Verteilungen.
Untergruppen und Beispiele
[Bearbeiten | Quelltext bearbeiten]Die Radikalische Polymerisation mit reversibler Deaktivierung lässt sich nach IUPAC in drei Untergruppen aufteilen:[1]
- Radikalische Polymerisation durch Atomtransfer (aus dem Engl.: atom-transfer radical polymerization (ATRP))
- Beispiel: Schlafende Spezies ist ein Polymerhalogenid, das sein Halogenatom (X•) auf einen Metall-Komplex übertragen kann und so zur radikalisch aktiven Spezies wird.
- Durch stabile Radikale vermittelte Polymerisation (aus dem Engl.: stable-radical-mediated polymerization (SRMP))
- Beispiel: Nitroxid-vermittelte (radikalische) Polymerisation (aus dem Engl.: nitroxide-mediated (radical) polymerization (NMP, NMRP)).
Die schlafende Spezies spaltet ein spezielles, schwach gebundenes Radikal ab, um zur radikalisch aktiven Spezies zu werden. Das abgespaltene Radikal ist ein stabiles, sterisch behindertes Nitroxid-Radikal, was sich wieder an eine aktive Spezies anlagern kann, aber nicht in der Lage ist, als Initiator zu wirken.
- Beispiel: Nitroxid-vermittelte (radikalische) Polymerisation (aus dem Engl.: nitroxide-mediated (radical) polymerization (NMP, NMRP)).
- Radikalische Polymerisation mit entartetem Transfer (aus dem Engl.: degenerate-transfer radical polymerization (DTRP))
In diesem Fall überträgt eine wachsende Kette ihre radikalischen Eigenschaften auf eine nicht wachsende Kette. Auf die Reaktivität hat dies keinen Einfluss, da beide energetisch gleichwertig sind, siehe entartete Reaktion.[10]- Beispiel: RAFT-Polymerisation (aus dem Engl.: reversible-addition-fragmentation chain-transfer polymerization (RAFT-polymerization)).
Derivate der Dithiobenzoesäure neigen zur Anlagerung von wachsenden Ketten. In recht komplexen Reaktionen wird eine aktive Ketten angelagert, wobei eine andere Kette abgespalten und aktiv wird. Beide sind vor der Addition bzw. nach der Abspaltung energetisch gleichwertig.
- Beispiel: RAFT-Polymerisation (aus dem Engl.: reversible-addition-fragmentation chain-transfer polymerization (RAFT-polymerization)).
In allen Beispielen wird unten die Synthese von Polystyrol (PS) behandelt. Das eigentliche Kettenwachstum unterscheidet sich nicht von konventionellen radikalischen Polymerisationen und ist auch bei den drei oben genannten Verfahren gleich. R steht hier für ein Radikal (R•), das den Kettenstart ausgelöst hat:
Damit ist eine wachsende Kette auch zu Abbruchreaktionen fähig.
Radikalische Polymerisation durch Atomtransfer
[Bearbeiten | Quelltext bearbeiten]Bei einer Radikalischen Polymerisation durch Atomtransfer werden in einer Gleichgewichtsreaktion ein Halogenatom von einer schlafenden Spezies auf einen Metallkomplex eines Übergangsmetalls übertragen, wobei eine radikalisch aktive Spezies zurückbleibt. Als Initiator der Polymerisation wird normalerweise ein Organohalogenid eingesetzt. In der Abbildung wurde (1-Bromethyl)benzol als Initiator verwendet und ein Kupferkomplex mit 2,2′-Bipyridin als Liganden (L) eingesetzt:[11]
Nitroxid-vermittelte Polymerisation
[Bearbeiten | Quelltext bearbeiten]In einer vorgelagerter Reaktion zerfällt bei einer Nitroxid-vermittelte Polymerisation eine Alkoxyaminverbindung in ein aktives Radikal R• und ein persistentes (stabiles) •O–N-Radikal. Das aktive Radikal initiiert die Polymerisation von Styrol, was das persistente Nitroxidradikal nicht kann. Dieses Radikal kann man als 2-Zentren-3-Elektronen-Radikal betrachten. Als Nitroxidradikal wird oft das sterisch behinderte 2,2,6,6-Tetramethylpiperidinyloxyl (TEMPO) eingesetzt. TEMPO führt zu einer reversiblen Deaktivierung einer wachsenden Kette durch Bildung eines aktiv-ruhenden Gleichgewichts:[12]
RAFT-Polymerisation
[Bearbeiten | Quelltext bearbeiten]Die gängigsten RAFT-Polymerisationen werden in Gegenwart von Dithiobenzoate (Ester der Dithiobenzoesäure) durchgeführt, die als RAFT-Reagenzien dienen. In mehreren (hier nicht gezeigten) Vorreaktionen unter Beteiligung eines Initiators bilden sich aktiv-ruhende Gleichgewichte. In der gezeigten Reaktion wurde als Initiator Azobis(isobutyronitril) (AIBN) und als RAFT-Reagenz 2-Cyano-2-propylbenzodithioat eingesetzt:[13]
Oben zeigt die Gleichgewichtsreaktion eine Addition einer radikalisch aktiven Spezies (links) an eine schlafende Spezies (rechts). Das Produkt der Addition ist selbst eine schlafende Spezies, kann jedoch durch Fragmentierung eine radikalisch aktive Spezies abscheiden.[14] Damit hat die aktive Spezies oben links ihren radikalischen Charakter auf die aktive Spezies unten rechts übertragen. Beide aktive Spezies und die schlafenden Spezies oben rechts und unten links haben die jeweils gleichen chemische Reaktivitäten, die Kettenübertragung ist daher thermodynamisch entartet. Dies steht im Gegensatz zu einer konventionellen radikalischen Polymerisation, bei der eine Kettenübertragung zu einer „toten“ und einer aktive Spezies führt.
Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ Die IUPAC rät im Bereich der Polymerwissenschaften von der Verwendung des Begriffs freies Radikal ab. Das Wort Radikal ist genügend.
- ↑ Es werden so viele Radikale gebildet, wie durch Abbruchreaktionen verbraucht werden. Übersteigt die Bildung der Radikale den Verbrauch, geht die Reaktion durch. Ist der Verbrauch grösser, kommt die Reaktion zum Erliegen. Der stationärer Zustand kann über längere Zeiten vorliegen. Bei hohen Umsätzen kann eine Selbstbeschleunigung auftreten. Davon sind besonders Massenpolymerisationen und Polymerisationen in konzentrierten Lösungen betroffen.
- ↑ Für den Vergleich mit einer Poisson-Verteilung sind die beiden Verteilungen vernachlässigbar unterschiedlich. Genau genommen gilt die Schulz-Flory-Verteilung nur für den Fall, dass nur Kettenübertragungsreaktionen das Wachstum der Ketten beendet.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Aubrey D. Jenkins, Richard G. Jones, Graeme Moad: Terminology for reversible-deactivation radical polymerization previously called "controlled" radical or "living" radical polymerization (IUPAC Recommendations 2010), In: Pure and Applied Chemistry, Bd. 82, Nr. 2, 2010, S. 483–491. (pdf)
- ↑ Ulrich Jonas, Patrick Theato: Glossar zu Begriffen mit Bezug zu Kinetik, Thermodynamik und Mechanismen von Polymerisationen (IUPAC-Empfehlungen), In: Angew. Chem., 2009, Bd. 121, Nr. 50, S. 9725–9738.
- ↑ Eintrag zu living polymerization. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.L03597 – Version: 3.0.1.
- ↑ Bernd Tieke: Makromolekulare Chemie, 3. Auflage, Wiley-VCH, Weinheim, 2014, S. 68 und 70.
- ↑ Erich Fitzer, Werner Fritz: Technische Chemie: Einführung in die chemische Reaktionstechnik, 3. Auflage, Springer, Berlin, Heidelberg, 1989, S. 420.
- ↑ Peter F. W. Simon, Amir Fahmi: Polymere - Chemie und Strukturen, 1. Auflage, Wiley-VCH, Weinheim, 2020, S. 75.
- ↑ Bodenstein'sches Quasistationaritätsprinzip Website chemgapedia.de. Abgerufen am 18. September 2020.
- ↑ Erich Fitzer, Werner Fritz: Technische Chemie: Einführung in die chemische Reaktionstechnik, 3. Auflage, Springer, Berlin, Heidelberg, 1989, S. 405.
- ↑ a b Peter F. W. Simon, Amir Fahmi, Polymere - Chemie und Strukturen, 1. Auflage, Wiley-VCH, Weinheim, 2020, S. 369 und 371.
- ↑ Peter F. W. Simon, Amir Fahmi: Polymere - Chemie und Strukturen, 1. Auflage, Wiley-VCH, Weinheim, 2020, S. 141.
- ↑ Peter F. W. Simon, Amir Fahmi: Polymere - Chemie und Strukturen, 1. Auflage, Wiley-VCH, Weinheim, 2020, S. 138f.
- ↑ Peter F. W. Simon, Amir Fahmi: Polymere - Chemie und Strukturen, 1. Auflage, Wiley-VCH, Weinheim, 2020, S. 137f.
- ↑ Peter F. W. Simon, Amir Fahmi: Polymere - Chemie und Strukturen, 1. Auflage, Wiley-VCH, Weinheim, 2020, S. 140f.
- ↑ Bernd Tieke, Makromolekulare Chemie, 3. Auflage, Wiley-VCH, Weinheim, 2014, S. 85f.