Azodicarbonsäurediethylester
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Azodicarbonsäurediethylester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H10N2O4 | ||||||||||||||||||
| Kurzbeschreibung |
orangefarbene Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 174,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,11 g·cm−3[2] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
mischbar mit Dichlormethan, Diethylether und Toluol[2] | ||||||||||||||||||
| Brechungsindex |
1,4210 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Azodicarbonsäurediethylester, meist mit DEAD (Diethylazodicarboxylat) abgekürzt, ist ein wichtiges Reagenz für die Mitsunobu-Reaktion, kann aber vielfältig eingesetzt werden.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Die Herstellung erfolgt über Derivate des Hydrazins, die durch geeignete Mittel dehydriert werden. Eine Möglichkeit ist die Oxidation mittels rauchender Salpetersäure.[3] Die Reaktion gelingt auch unter Verwendung von Chlor als Oxidationsmittel.[4]
Chemische Eigenschaften, Sicherheit
[Bearbeiten | Quelltext bearbeiten]DEAD ist toxisch, stoß- und lichtempfindlich und thermisch instabil. Die Verbindung ist explosionsgefährlich im Sinne des Sprengstoffgesetzes und ist dort der Stoffgruppe A zugeordnet.[5] Im Stahlhülsentest reagiert die Substanz mit einem Grenzdurchmesser von 20 mm äußerst heftig.[6] Die Schlagempfindlichkeit beträgt nur 4 J.[6] Im Bleiblocktest wird eine Ausdehnung von 33 ml/10 g beobachtet.[6] Oberhalb von 100 °C findet eine stark exotherme Zersetzung mit einer Zersetzungswärme von −1466 kJ·kg−1 bzw. −255 kJ·mol−1 statt.[6] Kommerziell ist es deshalb meist in gelöster Form, beispielsweise in Toluol, erhältlich. Als Reinstoff darf DEAD in den USA nicht versandt werden. Bedingt durch diese Sicherheitsrisiken ging die Verwendung von DEAD zurück, es wird meist durch das stabilere Diisopropylazodicarboxylat (DIAD) ersetzt.
Beim Destillieren kann DEAD explodieren. Geeignete Sicherheitsvorkehrungen sind zu treffen. Direkte Lichtquellen sollen abgeschirmt werden.[4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Mitsunobu-Reaktion
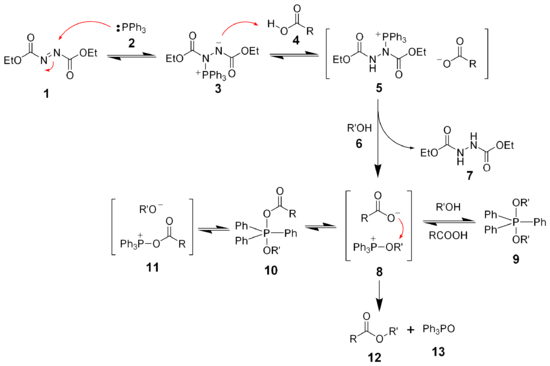
[Bearbeiten | Quelltext bearbeiten]Das klassische Anwendungsgebiet von DEAD ist die Mitsunobu-Reaktion, die der Synthese von Estern, Ethern, Aminen und Thioethern aus Alkoholen dient.
Enophil
[Bearbeiten | Quelltext bearbeiten]Ein weiterer Anwendungsbereich von DEAD ist die Verwendung als Enophil beispielsweise in En-Reaktionen.[7]

Dienophil
[Bearbeiten | Quelltext bearbeiten]Auch die Verwendung als Dienophil ist in der Literatur beschrieben. So gelang beispielsweise die Synthese von Bicyclo[2.1.0]pentan ausgehend von Cyclopentadien und DEAD.[8]
Michael-Akzeptor
[Bearbeiten | Quelltext bearbeiten]Die Azogruppe in DEAD ist auch ein Michael-Akzeptor. In Gegenwart von Kupferkatalysatoren addiert DEAD an β-Ketoester zu den entsprechenden Hydrazinderivaten.[9]

Auf ähnliche Weise katalysiert Cu(II) auch die Substitution von Boronsäureestern in fast quantitativer Ausbeute.[10]

Synthese von Pyrrazolin-Derivaten
[Bearbeiten | Quelltext bearbeiten]DEAD kann auch zur Synthese von Heterocyclen eingesetzt werden. So können Pyrrazolinderivate durch Kondensation an α,β-ungesättigte Ketone erhalten werden.[11]:

Literatur
[Bearbeiten | Quelltext bearbeiten]- Clayden, Greeves, Warren & Wothers: Organic Chemistry. Oxford University Press, August 2004, ISBN 0-19-850346-6
- O. Mitsunobu, M. Wada, T. Sano: Stereospecific and stereoselective reactions. I. Preparation of amines from alcohols in J. Am. Chem. Soc. 94 (1972) 679–680, doi:10.1021/ja00757a085.
- R. F. C. Brown, W. R. Jackson, T. D. McCarthy: Potential routes to flavan-3-ols, part 2: The Mitsunobu reactions of para-oxygenated benzylic alcohols in Tetrahedron 50 (1994) 5469–5488, doi:10.1016/S0040-4020(01)80702-X. (Methodenentwicklung)
- O. Mitsunobu: The Use of Diethyl Azodicarboxylate and Triphenylphosphine in Synthesis and Transformation of Natural Products in Synthesis 1981, 1–28, doi:10.1055/s-1981-29317. (Übersicht)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu Diazendicarbonsäure-diethylester. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ a b c d e Datenblatt Diethyl azodicarboxylate, 97% bei Alfa Aesar, abgerufen am 26. Dezember 2019 (Seite nicht mehr abrufbar).
- ↑ Norman Rabjohn: Ethyl Azodicarboxylate In: Organic Syntheses. 28, 1948, S. 58, doi:10.15227/orgsyn.028.0058; Coll. Vol. 3, 1955, S. 375 (PDF).
- ↑ a b J. C. Kauer: Ethyl Azodicarboxylate. In: Organic Syntheses, Coll. Vol. 4 (1963), S. 411, doi:10.1002/0471264180.os900.12 (PDF).
- ↑ Bekanntmachung der gemäß § 2 SprengG von der BAM seit 1987 neu getroffenen Feststellungen - Feststellungsbescheid 402 von 16. Februar 2001 pdf-Link.
- ↑ a b c d Berger, A.; Wehrstedt, K.D.: Azodicarboxylates: Explosive properties and DSC measurements in J. Loss Prev. Proc. Ind. 23 (2010) 734–739, doi:10.1016/j.jlp.2010.06.019.
- ↑ Lehmann, Neumann: En-Reaktion ( vom 11. Juni 2007 im Internet Archive), Uni Hannover.
- ↑ P. G. Gassman und K. T. Mansfield: Bicyclo[2.1.0]pentane In: Organic Syntheses. 49, 1969, S. 1, doi:10.15227/orgsyn.049.0001; Coll. Vol. 5, 1973, S. 96 (PDF).
- ↑ Comelles, J.; Moreno-Mañas, M.; Pérez, E.; Roglans, A.; Sebastián, R.M.; Vallribera, A.: Ionic and Covalent Copper(II)-Based Catalysts for Michael Additions. The Mechanism. In: J. Org. Chem. 69, 2004, 6834–6842, doi:10.1021/jo049373z.
- ↑ Uemura, T.; Chatani, N.: Copper Salt Catalyzed Addition of Arylboronic Acids to Azodicarboxylates. In: J. Org. Chem. 70 (2005) 8631–8634, doi:10.1021/jo051387x.
- ↑ Vijay, N.; Smith, C.M.; Akkattu, T.B.; Eringathodi, S.: A Novel Reaction of the “Huisgen Zwitterion” with Chalcones and Dienones: An Efficient Strategy for the Synthesis of Pyrazoline and Pyrazolopyridazine Derivatives. In: Angew. Chem. Int. Ed. 46 (2007) 2070–2073, doi:10.1002/anie.200604025.
