Toll-like-Rezeptoren
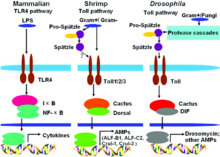
Toll-like-Rezeptoren (kurz TLR, englisch toll-like receptor) sind Strukturen des angeborenen Abwehrsystems (innate immunity) und gehören zu einer Gruppe von Rezeptoren, den PRRs (Pattern-Recognition Receptors). Sie dienen der Erkennung von PAMPs (Pathogen-Associated Molecular Patterns). Das sind Strukturen, welche ausschließlich auf oder in Krankheitserregern vorkommen, und steuern entsprechende Aktivierungen von Genen. Hierdurch wird die Aktivierung des „antigen-spezifischen erworbenen Immunsystems“ (antigen-specific acquired immunity) eingeleitet und moduliert. Durch die „toll-like receptors“ vermag das angeborene Abwehrsystem zwischen „selbst“ und „nicht selbst“ zu unterscheiden.[1] TLRs werden im Allgemeinen in dendritischen Zellen und Makrophagen exprimiert, wenig bis gar nicht in Epithelzellen.
Der Name Toll-like-Rezeptor (in der deutschsprachigen Literatur als Signaltransduktions-vermittelnde PRRs[1] oder selten auch als Toll-artiger Rezeptor bezeichnet) ist von einem Protein bei Drosophila melanogaster abgeleitet, über dessen Entdeckung die Forschungsgruppe um die Nobelpreisträgerin Christiane Nüsslein-Volhard derart begeistert war, dass sie es humorvoll nach dem deutschen Ausdruck toll nannte. Der Moment, der dem Toll-Gen der Fruchtfliege seinen Namen gab, war, als sie ihrem Kollegen Eric Wieschaus gegenüber an einem Doppelmikroskop saß, das zwei Personen gleichzeitig die Untersuchung desselben Objekts erlaubt. „Als wir eines Tages eine Embryonenmutante sahen, deren Entwicklung ventralisiert war, waren wir beide vollkommen überrascht und haben spontan ‚toll‘ gerufen. Bis dahin kannten wir nur dorsalisierte Embryonen“.[2] TLRs bestehen aus Proteinen, die Toll ähneln, also toll-like sind.
Seit der Entdeckung des ersten Toll-like-Rezeptoren Mitte der 1990er Jahre sind immer wieder neue Varianten in Menschen und Tieren entdeckt worden. TLRs finden sich in allen Vertebraten, aber auch in einfacheren Organismen wie zum Beispiel in Drosophila melanogaster, was nahelegt, dass es sich um ein evolutionär sehr altes System handelt. Die meisten Spezies verfügen über mehr als zehn verschiedene (bekannte) TLRs, wobei manche Typen z. B. in der Maus, jedoch nicht im Menschen vorkommen.
TLRs erkennen verschiedene funktionale Bestandteile von Viren, Bakterien und Pilzen und können so biochemische Reaktionsketten in den Zellen auslösen, die der Abwehr dieser Krankheitserreger dienen.
Entdeckung der TLRs
[Bearbeiten | Quelltext bearbeiten]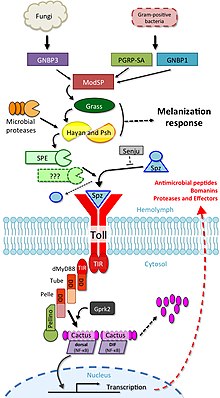
Als Mikroganismen erstmals als die Ursache für Infektionskrankheiten identifiziert wurden, war klar, dass mehrzellige Organismen diese erkennen können müssen und dass es dafür notwendig ist, für Mikroorganismen typische Molekülstrukturen zu erkennen. Eine große Menge an Literatur, die den Großteil des 20. Jahrhunderts umfasste, widmet sich den Schlüsselmolekülen und ihren Rezeptoren. Vor mehr als 100 Jahren prägte Richard Pfeiffer, ein Schüler von Robert Koch, den Begriff Endotoxin, um eine Substanz, die von gramnegativen Bakterien produziert wurde und bei Tierversuchen zu Fieber und Schockzuständen führte, zu benennen. In den folgenden Jahrzehnten wurden die Endotoxine chemisch charakterisiert und als Lipopolysaccharide (LPS), die von den meisten gramnegativen Bakterien produziert werden, identifiziert. Es wurde gezeigt, dass auch andere Moleküle (bakterielle Lipopeptide, Flagelline und nicht methylierte DNA) zu einer Immunantwort führen. Logischerweise wurde daraus geschlossen, dass es Rezeptoren geben muss, die in der Lage sind, eine Immunantwort für solche Molekülstrukturen herbeizuführen. Diese wurden jedoch viele Jahre lang nicht gefunden.
In der Mitte der 1990er wurde durch Forschungen im Bereich der Entwicklungsbiologie von Drosophila melanogaster eher zufällig erkannt, dass Toll-negative Mutanten sehr anfällig gegen Pilzbefall sind.[7] Diese Beobachtung leitete eine gezielte Suche nach ähnlichen Proteinen in Säugerzellen ein. 1994 konnte von Nomura und Kollegen der erste menschliche TLR gefunden werden, der 1996 von Taguchi und Kollegen einem Chromosom zugeordnet werden konnte. Dies zeigt, dass es sich bei der über Toll-like Receptor vermittelten Immunantwort um eine evolutionär sehr alte Form handelt, die genetisch hochkonserviert ist. Da die Rolle der TLRs bei der Immunabwehr zum damaligen Zeitpunkt noch nicht bekannt war, wurde angenommen, dass TLR-1 in der Entwicklungsbiologie der Säugetiere eine Rolle spielen würde. 1997 zeigten Charles Janeway und Ruslan Medzhitov, dass ein Toll-like Receptor, wenn er künstlich an entsprechende Antikörper gebunden wird, bestimmte Gene aktivieren kann, die für eine adaptive Immunantwort nötig sind. Die Funktion des TLR-4 als LPS-Rezeptor wurde von Bruce A. Beutler und Kollegen entdeckt. Im Laufe der Zeit wurden auch die Liganden der anderen TLRs bestimmt. Shizuo Akira nahm dabei eine zentrale Rolle ein.
Struktur und Liganden
[Bearbeiten | Quelltext bearbeiten]Die gemeinsamen Strukturmerkmale aller Toll-like-Rezeptoren sind die N-terminalen leucinreichen LRR-Sequenzen (Leucine-rich Repeats) und die TIR-Domain (Toll/IL-1R homology domain). Die unterschiedlichen TLRs können jeweils unterschiedliche PAMPs (Pathogen Associated Molecular Patterns) durch direkte Interaktion mit der jeweiligen Membranoberfläche des Krankheitserregers identifizieren. TLR-3, TLR-7, TLR-8 und TLR-9 befinden sich an der Membran von Endosomen bzw. Endolysosomen, während die restlichen Toll-like-Rezeptoren an der Zellmembran sitzen.[8]
TLR-2 erkennt viele Komponenten von Bakterien, Mykoplasmen, Pilzen und Viren. Hierzu gehören auch die Lipoproteine der Bakterien und Mykoplasmen. Die Erkennung erfolgt, indem TLR2 entweder mit TLR1 oder TLR6 eine Heterodimer bildet. Die entstehenden TLR-1/TLR-2- und TLR-6/TLR-2-Komplexe erkennen dabei Triacyl- bzw. Diacyllipoproteine. Die Aktivierung von TLR2 führt zur Ausschüttung einer Reihe von Zytokinen. Alpha-Interferon (IFN-α) wird dabei nur teilweise freigesetzt. Allgemein wird vermutet, dass die Ausschüttung von IFN-α vom Zelltyp abhängig ist. TLR-10 ähnelt in seiner Primärstruktur (Sequenzübereinstimmung) TLR-1 und TLR-6, der Ligand ist jedoch noch nicht bekannt. TLR-4 kann Lipopolysaccharid (LPS) auf der Zelloberfläche zusammen mit MD2 (myeloid differentiation factor 2) erkennen. LPS ist ein Stoff aus der äußeren Membran von gramnegativen Bakterien und wird in Tiermodellen zur eingeschränkten Simulation von akuten Infektionen verwendet. Bei der Detektion von LPS arbeiten zwei TLR4-MD2-LPS-Komplexe zusammen und formen ein TLR4-Homodimer.
TLR5 wird hauptsächlich in der Lamina propria exprimiert, wo es bakterielles Flagellin erkennt. Als Immunantwort darauf induziert TLR-5 die Ausdifferenzierung von B-Zellen in lgA-produzierende Blutzellen und von T-Zellen in antigenspezifische Th17- und Th1-Zellen. TLR-11 das nur in der Maus, aber nicht im Menschen vorkommt, zeigt große Ähnlichkeiten zu TLR-5. Es erkennt ein Profilin-ähnliches Molekül, das vom intrazellulären Protozoon Toxoplasma gondii abstammt. Eine Reihe von TLRs, darunter TLR-3, TLR-7, TLR-8 und TLR-9 erkennen aus Viren oder Bakterien stammende Nukleinsäuren. Die Aktivierung dieser TLRs führt zur Bildung von Alpha-Interferon und anderen entzündungsauslösenden Zytokinen. TLR-3 entdeckt virale doppelsträngige RNA im Endolysosom. Hierbei bindet die dsRNA an das N-terminale und das C-terminale Ende der LRR-Sequenz.
| Rezeptor | Liganden[9] | Ursprung der Liganden[9] | Adapterprotein des TLR | Zelluläre Lokalisation | Zelltypen[9] |
|---|---|---|---|---|---|
| TLR-1 | Verschiedene Triacyl-Lipopeptide | Bakterielles Lipoprotein | MyD88/MAL | Zelloberfläche |
|
| TLR-2 | Verschiedene Glycolipide | Bakterielle Peptidoglykane | MyD88/MAL | Zelloberfläche |
|
| Verschiedene Lipopeptide und Proteolipide | Bakterielle Peptidoglycane | ||||
| Lipoteichonsäure | Gram-positive Bakterien | ||||
| HSP70 | Wirtszellen | ||||
| Zymosan (Beta-Glucan) | Pilze | ||||
| Zahlreiche Andere | |||||
| TLR-3 | Doppelsträngige RNA, Poly I:C[12] | Viren | TRIF | Zellkompartiment |
|
| TLR-4 | Lipopolysaccharide, Eritoran[13][14] | Gram-negative Bakterien | MyD88/MAL/TRIF/TRAM | Zelloberfläche |
|
| Mehrere Hitzeschockproteine | Bakterien und Wirtszellen | ||||
| Fibrinogen | Wirtszellen | ||||
| Heparansulfatfragmente | Wirtszellen | ||||
| Hyaluronsäurefragmente | Wirtszellen | ||||
| Nickel[17] | |||||
| Verschiedene Opioide | |||||
| TLR-5 | Bakterielles Flagellin | Bakterien | MyD88 | Zelloberfläche |
|
| Profilin[18] | Toxoplasma gondii | ||||
| TLR-6 | Verschiedene Diacyl-Lipopeptide | Mycoplasma | MyD88/MAL | Zelloberfläche |
|
| TLR-7 | Imidazochinolin | Niedermolekulare synthetische Stoffe | MyD88 | Zellkompartiment |
|
| Loxoribin (ein Guanosinanalogon) | |||||
| Bropirimin | |||||
| Imiquimod, Resiquimod[1] | |||||
| Einzelsträngige RNA | RNA-Viren | ||||
| TLR-8 | Niedermolekulare synthetische Stoffe, RNase-prozessierte virale und bakterielle RNA[19], Resiquimod[1] | MyD88 | Zellkompartiment |
| |
| TLR-9 | Unmethylierte CpG-Oligonukleotide (DNA)[20] | Bakterien, DNA-Viren | MyD88 | Zellkompartiment |
|
| TLR-10 | Triacylierte Lipopeptide[21] | unbekannt | Zelloberfläche | ||
| TLR-11 | Profilin | Toxoplasma gondii[25] | MyD88 | Zellkompartiment[26] |
|
| TLR-12 | Profilin | Toxoplasma gondii[27] | MyD88 | Zellkompartiment | |
| TLR-13[29][30] | Bakterielle ribosomale RNA-Sequenz CGGAAAGACC (unmethyliert)[31] | Viren, Bakterien | MyD88, TAK-1 | Zellkompartiment |
|
Die intrazelluläre Signalkaskade
[Bearbeiten | Quelltext bearbeiten]
Die Chemoattraktorproteine „C3a“ und „C5a“ des Komplementsystems entstehen durch proteolytische Spaltung aus den inaktiven Vorstufen C3, bzw. C5. Aktiviert locken sie Makrophagen und neutrophile Granulozyten an. Diese Phagozyten haben auf ihrer Oberfläche Rezeptoren vom TLR-Typ. Die TLRs reagieren auf bakterielle Proteoglykane bzw. Lipopolysaccharide (LPS), DNA und RNA. Sie lösen in ihren Trägerzellen eine Signalkaskade aus, die schließlich zur Stimulation der Infektionsabwehr führt. Nach Erkennen dieser bakteriellen Oberflächenstrukturen auf extrazellulärer Seite, werden intrazellulär – durch TLR – Signalkaskaden ausgelöst.
Die Erkennung von PAMPs (Pathogen Associated Molecular Patterns) durch TLRs führt zu einer Erhöhung der Transkriptionsrate bestimmter Gene, je nachdem welche TLRs und welche Zelltypen beteiligt sind. Der Unterschied zwischen den von den einzelnen TLRs aktivierten Signalkaskaden kann zumindest teilweise durch die TIR-domain enthaltenden Adaptormoleküle (TIR domain-containing adaptor molecules) erklärt werden. Es gibt dabei fünf TIR domain-containing adaptor molecules, darunter MyD88, TRIF/TICAM-1 (TIR-domain-containing adaptor inducing IFN-β), TIRAP/Mal, TRAM (TRIF-related adaptor molecule), und SARM (Sterile-alpha and Armadillo motif-containing protein). TLR-Signalketten werden abhängig von der Beteiligung der Adaptormoleküle MyD88 und TRIF grob in zwei unterschiedliche Reaktionsketten unterteilt.
Dabei kommt es zur Phosphorylierung und somit Aktivierung intrazellulärer Kinasen, deren Aufgabe in der Phosphorylierung intrazellulärer Inhibitoren von Transkriptionsfaktoren besteht. Als Erstes bindet das Adapterprotein MyD88 an den zytoplasmatischen Abschnitt des TLR. Als Folge bindet nun die IL-1-Rezeptor-assoziierte Kinase (IRAK) an MyD88 und aktiviert sich durch Autophosphorylation selbst. Über weitere Einzelschritte kommt es schließlich zur Aktivierung des Transkriptionsfaktors NF-κB, der daraufhin in den Zellkern transloziert und dort die Expression von Genen für TNFα, IL-1, IL-12 und E-Selektin reguliert.
Literatur
[Bearbeiten | Quelltext bearbeiten]- K. Takeda, S. Akira: Toll-like receptors in innate immunity. In: International immunology, Band 17, Nummer 1, Januar 2005, S. 1–14; ISSN 0953-8178, doi:10.1093/intimm/dxh186, PMID 15585605 (Review).
- Luke A. J. O’Neill: Das immunologische Frühwarnsystem. In: Spektrum der Wissenschaft, August 2005, S. 68–75.
- S. E. Turvey, T. R. Hawn: Towards subtlety: understanding the role of Toll-like receptor signaling in susceptibility to human infections. In: Clinical immunology (Orlando FL), Band 120, Nr. 1, Juli 2006, S. 1–9; ISSN 1521-6616, doi:10.1016/j.clim.2006.02.003, PMID 16563867 (Review).
- Nicola Siegmund-Schultze: Toll-like-Rezeptoren: Neue Zielstruktur für immunstimulierende Medikamente. In: Deutsches Ärzteblatt. Band 104, Nr. 16, 20. April 2007, S. A-1072 / B-954 / C-908 (aerzteblatt.de).
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Peter Fritsch: Dermatologie und Venerologie. 2. Auflage. Springer Verlag, 2004, ISBN 3-540-00332-0.
- ↑ Toll-like Receptor. In: Deutsch. Arztebl, 2007, 104(16), S. A-1072 / B-954 / C-908; abgerufen am 8. Juni 2020.
- ↑ B. Lemaitre, J. Hoffmann: The host defense of Drosophila melanogaster. In: Annual Review of Immunology. Band 25, 2007, S. 697–743, doi:10.1146/annurev.immunol.25.022106.141615, PMID 17201680.
- ↑ S. Valanne, J.H. Wang, M. Rämet: The Drosophila Toll signaling pathway. In: Journal of Immunology. Band 186, Nr. 2, Januar 2011, S. 649–656, doi:10.4049/jimmunol.1002302, PMID 21209287.
- ↑ J.P. Dudzic, M.A. Hanson, I. Iatsenko, S. Kondo, B. Lemaitre: More Than Black or White: Melanization and Toll Share Regulatory Serine Proteases in Drosophila. In: Cell Reports. Band 27, Nr. 4, April 2019, S. 1050–1061.e3, doi:10.1016/j.celrep.2019.03.101, PMID 31018123.
- ↑ M.A. Hanson, P.T. Hamilton, S.J. Perlman: Immune genes and divergent antimicrobial peptides in flies of the subgenus Drosophila. In: BMC Evolutionary Biology. Band 16, Nr. 1, Oktober 2016, S. 228, doi:10.1186/s12862-016-0805-y, PMID 27776480.
- ↑ B. Lemaitre, E. Nicolas, L. Michaut, J. M. Reichhart, J. A. Hoffmann: The dorsoventral regulatory gene cassette spätzle/Toll/cactus controls the potent antifungal response in Drosophila adults. In: Cell. Band 86, Nummer 6, September 1996, ISSN 0092-8674, S. 973–983, PMID 8808632.
- ↑ T. Kawai, S. Akira: The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors. In: Nature Immunology. Band 11, Nummer 5, Mai 2010, S. 373–384, doi:10.1038/ni.1863, PMID 20404851 (Review).
- ↑ a b c Die Quelle ist, sofern nicht anders in den Tabelleneinträgen angegeben: C. Waltenbaugh, T. Doan, R. Melvold, S. Viselli: Immunology (= Lippincott’s Illustrated reviews). Wolters Kluwer Health / Lippincott Williams & Wilkins, Philadelphia 2008, ISBN 978-0-7817-9543-2, S. 17.
- ↑ a b I. Sabroe, S.K. Dower, M.K. Whyte: The role of Toll-like receptors in the regulation of neutrophil migration, activation, and apoptosis. In: Clinical Infectious Diseases. 41 Suppl 7, November 2005, S. S421–426, doi:10.1086/431992, PMID 16237641.
- ↑ a b c d F. Sallusto, A. Lanzavecchia: The instructive role of dendritic cells on T-cell responses. In: Arthritis Research. 4 Suppl 3, 2002, S. S127–132, doi:10.1186/ar567, PMID 12110131, PMC 3240143 (freier Volltext).
- ↑ C. F. Nicodemus, J. S. Berek: TLR3 agonists as immunotherapeutic agents. In: Immunotherapy. Band 2, Nummer 2, März 2010, S. 137–140, doi:10.2217/imt.10.8, PMID 20635920.
- ↑ K. A. Shirey, W. Lai u. a.: The TLR4 antagonist Eritoran protects mice from lethal influenza infection. In: Nature. Band 497, Nummer 7450, Mai 2013, ISSN 1476-4687, S. 498–502, doi:10.1038/nature12118, PMID 23636320, PMC 3725830 (freier Volltext).
- ↑ E. J. Hennessy, A. E. Parker, L. A. O’Neill: Targeting Toll-like receptors: emerging therapeutics? In: Nature reviews. Drug discovery. Band 9, Nummer 4, April 2010, ISSN 1474-1784, S. 293–307, doi:10.1038/nrd3203, PMID 20380038 (Review).
- ↑ S. Gerondakis, R.J. Grumont, A. Banerjee: Regulating B-cell activation and survival in response to TLR signals. In: Immunology and Cell Biology. Band 85, Nr. 6, 2007, S. 471–475, doi:10.1038/sj.icb.7100097, PMID 17637697.
- ↑ E. Cario, I.M. Rosenberg, S.L. Brandwein, P.L. Beck, H.C. Reinecker, D.K. Podolsky: Lipopolysaccharide activates distinct signaling pathways in intestinal epithelial cell lines expressing Toll-like receptors. In: Journal of Immunology. Band 164, Nr. 2, Januar 2000, S. 966–972, doi:10.4049/jimmunol.164.2.966, PMID 10623846.
- ↑ M. Peana, K. Zdyb, S. Medici, A. Pelucelli, G. Simula, E. Gumienna-Kontecka, M.A. Zoroddu: Ni(II) interaction with a peptide model of the human TLR4 ectodomain. In: Journal of Trace Elements in Medicine and Biology. Band 44, Dezember 2017, S. 151–160, doi:10.1016/j.jtemb.2017.07.006, PMID 28965571.
- ↑ R.M. Salazar Gonzalez, H. Shehata, M.J. O’Connell, Y. Yang, M.E. Moreno-Fernandez, C.A. Chougnet, J. Aliberti: Toxoplasma gondii- derived profilin triggers human toll-like receptor 5-dependent cytokine production. In: Journal of Innate Immunity. Band 6, Nr. 5, 2014, S. 685–694, doi:10.1159/000362367, PMID 24861338, PMC 4141014 (freier Volltext).
- ↑ Thomas Ostendorf, Thomas Zillinger, Katarzyna Andryka, Thais Marina Schlee-Guimaraes, Saskia Schmitz: Immune Sensing of Synthetic, Bacterial, and Protozoan RNA by Toll-like Receptor 8 Requires Coordinated Processing by RNase T2 and RNase 2. In: Immunity. Band 52, Nr. 4, April 2020, S. 591–605.e6, doi:10.1016/j.immuni.2020.03.009 (Online [abgerufen am 18. September 2020]).
- ↑ C. Maisonneuve, S. Bertholet u. a.: Unleashing the potential of NOD- and Toll-like agonists as vaccine adjuvants. In: Proceedings of the National Academy of Sciences. Band 111, Nummer 34, August 2014, ISSN 1091-6490, S. 12294–12299, doi:10.1073/pnas.1400478111, PMID 25136133, PMC 4151741 (freier Volltext) (Review).
- ↑ Y. Guan, D.R. Ranoa, S. Jiang, S.K. Mutha, X. Li, J. Baudry, R.I. Tapping: Human TLRs 10 and 1 share common mechanisms of innate immune sensing but not signaling. In: Journal of Immunology (Baltimore, Md.: 1950). Band 184, Nr. 9, Mai 2010, S. 5094–5103, doi:10.4049/jimmunol.0901888, PMID 20348427.
- ↑ T. Chuang, R.J. Ulevitch: Identification of hTLR10: a novel human Toll-like receptor preferentially expressed in immune cells. In: Biochimica Et Biophysica Acta. Band 1518, Nr. 1–2, März 2001, S. 157–161, doi:10.1016/s0167-4781(00)00289-x, PMID 11267672.
- ↑ V. Hornung, S. Rothenfusser, S. Britsch, A. Krug, B. Jahrsdörfer, T. Giese, S. Endres, G. Hartmann: Quantitative expression of toll-like receptor 1-10 mRNA in cellular subsets of human peripheral blood mononuclear cells and sensitivity to CpG oligodeoxynucleotides. In: Journal of Immunology. Band 168, Nr. 9. Baltimore Mai 2002, S. 4531–4537, doi:10.4049/jimmunol.168.9.4531, PMID 11970999.
- ↑ a b T. Regan, K. Nally, R. Carmody, A. Houston, F. Shanahan, J. Macsharry, E. Brint: Identification of TLR10 as a key mediator of the inflammatory response to Listeria monocytogenes in intestinal epithelial cells and macrophages. In: Journal of Immunology. Band 191, Nr. 12, Dezember 2013, S. 6084–6092, doi:10.4049/jimmunol.1203245, PMID 24198280.
- ↑ F. Yarovinsky, D. Zhang, J.F. Andersen, G.L. Bannenberg, C.N. Serhan, M.S. Hayden, S. Hieny, F.S. Sutterwala, R.A. Flavell, S. Ghosh, A. Sher: TLR11 activation of dendritic cells by a protozoan profilin-like protein. In: Science. Band 308, Nr. 5728, Juni 2005, S. 1626–1629, doi:10.1126/science.1109893, PMID 15860593, bibcode:2005Sci...308.1626Y.
- ↑ R. Pifer, A. Benson, C.R. Sturge, F. Yarovinsky: UNC93B1 is essential for TLR11 activation and IL-12-dependent host resistance to Toxoplasma gondii. In: The Journal of Biological Chemistry. Band 286, Nr. 5, Februar 2011, S. 3307–3314, doi:10.1074/jbc.M110.171025, PMID 21097503, PMC 3030336 (freier Volltext).
- ↑ A.A. Koblansky, D. Jankovic, H. Oh, S. Hieny, W. Sungnak, R. Mathur, M.S. Hayden, S. Akira, A. Sher, S. Ghosh: Recognition of profilin by Toll-like receptor 12 is critical for host resistance to Toxoplasma gondii. In: Immunity. Band 38, Nr. 1, Januar 2013, S. 119–130, doi:10.1016/j.immuni.2012.09.016, PMID 23246311, PMC 3601573 (freier Volltext).
- ↑ B.B. Mishra, U.M. Gundra, J.M. Teale: Expression and distribution of Toll-like receptors 11-13 in the brain during murine neurocysticercosis. In: Journal of Neuroinflammation. Band 5, Dezember 2008, S. 53, doi:10.1186/1742-2094-5-53, PMID 19077284, PMC 2631477 (freier Volltext).
- ↑ Z. Shi, Z. Cai, A. Sanchez, T. Zhang, S. Wen, J. Wang, J. Yang, S. Fu, D. Zhang: A novel Toll-like receptor that recognizes vesicular stomatitis virus. In: The Journal of Biological Chemistry. Band 286, Nr. 6, Februar 2011, S. 4517–4524, doi:10.1074/jbc.M110.159590, PMID 21131352, PMC 3039399 (freier Volltext).
- ↑ M. Oldenburg, A. Krüger, R. Ferstl, A. Kaufmann, G. Nees, A. Sigmund, B. Bathke, H. Lauterbach, M. Suter, S. Dreher, U. Koedel, S. Akira, T. Kawai, J. Buer, H. Wagner, S. Bauer, H. Hochrein, C.J. Kirschning: TLR13 recognizes bacterial 23S rRNA devoid of erythromycin resistance-forming modification. In: Science. Band 337, Nr. 6098, August 2012, S. 1111–1115, doi:10.1126/science.1220363, PMID 22821982, bibcode:2012Sci...337.1111O.
- ↑ H. Hochrein, C.J. Kirschning: Bacteria evade immune recognition via TLR13 and binding of their 23S rRNA by MLS antibiotics by the same mechanisms. In: Oncoimmunology. Band 2, Nr. 3, März 2013, S. e23141, doi:10.4161/onci.23141, PMID 23802068, PMC 3661153 (freier Volltext).