Silberacetylid
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
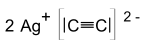
| |||||||
| Allgemeines | |||||||
| Name | Silberacetylid | ||||||
| Andere Namen |
Sprengsilber | ||||||
| Summenformel | Ag2C2 | ||||||
| Kurzbeschreibung | |||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 239,76 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt |
Zersetzung ab 120 °C[3] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Silberacetylid ist ein chemische Verbindung aus Silber und Kohlenstoff mit der Summenformel Ag2C2.
Eigenschaften und Gefahren
[Bearbeiten | Quelltext bearbeiten]Silberacetylid bildet weiße, explosive Kristalle und gehört zu den Carbiden. Da sich das Carbid-Ion [C≡C]2− formal vom Ethin (Acetylen) ableiten lässt, zählt man es zu einer Untergruppe der Carbide, nämlich zu den Acetyliden. Die Verbindung kann durch Schlag, Reibung und andere Zündquellen zur Explosion gebracht werden. Dies kann schon durch eine Berührung erfolgen.[2] Mit einer Belastung von 0,1 N ist es extrem reibempfindlich.[5] Mit Silbernitrat wird ein explosionsfähiger Komplex gebildet.[2] Reines Silberacetylid hat eine Detonationsgeschwindigkeit von etwa 1200 m/s.[6]
Herstellung im Labormaßstab
[Bearbeiten | Quelltext bearbeiten]
Zur Herstellung im Labormaßstab macht man sich die geringe Löslichkeit von Silberacetylid in Wasser zunutze: Wenn gasförmiges Ethin in eine wässrige Lösung eines gut löslichen Silbersalzes eingeleitet wird, fällt Silberacetylid als farbloser bis grauer Niederschlag aus.[7] Dieser kann abfiltriert und vorsichtig getrocknet werden. Dabei ist mit äußerster Vorsicht vorzugehen, da Silberacetylid zu unkontrollierter Zersetzung (Explosion) neigt. Die Herstellung gelingt besser, wenn Ethin in eine ammoniakalische Silbersalzlösung eingeleitet wird, da Ammoniak die Protonen des Ethins bindet. Silberacetylid fällt dann in großer Menge aus.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Paul Hölemann, Rolf Hasselmann: Die Anreicherung von Phosphor- und Schwefelverunreinigungen in Acetylen-Flaschen. Westdt. Verlag, 1959.
- Paul Hölemann, Rolf Hasselmann: Die Abhängigkeit des Volumens gesättigter Acetylen-Aceton-Lösungen von Temperatur und Konzentration. Westdt. Verlag, 1959.
- Paul Hölemann, Rolf Hasselmann: Bestimmung des Dampfdruckes und der Verdampfungswärme von flüssigem Acetylen. Westdt. Verlag, 1959.
- Paul Hölemann, Rolf Hasselmann: Die Druckabhängigkeit der Zündgrenzen von Acetylen-Sauerstoffgemischen. Westdt. Verlag, 1961.
- Alfred Stettbacher: Die Schieß- und Sprengstoffe. Leipzig 1933.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu Silber-organische Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- ↑ a b c L. Roth, U. Weller-Schäferbarthold: Gefährliche Chemische Reaktionen - Potentiell gefährliche chemische Reaktionen zu über 1750 Stoffen, Eintrag für Silberacetylid, CD-ROM Ausgabe 8/2021, ecomed Sicherheit Landsberg/Lech, ISBN 978-3-609-48040-4.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Köhler, J.; Meyer, R.; Homburg, A.: Explosivstoffe, zehnte, vollständig überarbeitete Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7.
- ↑ Matyáš Jiří, Robert Pachman: Primary Explosives. Springer Berlin Heidelberg, Berlin, Heidelberg 2013, ISBN 978-3-642-28435-9, doi:10.1007/978-3-642-28436-6 (englisch).
- ↑ powerlabs.org
