Anaerobie
Anaerobie (zu altgriechisch ἀήρ aer ‚Luft‘ und βίος bios ‚Leben‘; mit Alpha privativum α(ν)- a(n)- ‚ohne‘) bezeichnet Leben ohne Sauerstoff (Disauerstoff O2). Lebewesen, die für ihren Stoffwechsel keinen molekularen Sauerstoff brauchen, werden als anaerob bezeichnet. Jene Anaerobier, die durch O2 gehemmt oder sogar abgetötet werden, werden genauer obligat anaerob benannt.
Anaerobe Lebensformen
[Bearbeiten | Quelltext bearbeiten]Anaerobe einzellige Organismen sind die ältesten Formen des Lebens auf der Erde, noch vor den ersten oxygen photosynthetisch aktiven Einzellern im Präkambrium, die O2 ausschieden. Mit dessen Anreicherung in der Hydrosphäre und der Atmosphäre änderten sich die Lebensbedingungen großräumig (siehe Große Sauerstoffkatastrophe). Die heute lebenden anaeroben Organismen benötigen ebenfalls alle keinen Sauerstoff für ihren Stoffwechsel und lassen sich grob danach unterscheiden, wie gut sie mit einer sauerstoffhaltigen Umgebung zurechtkommen:
- Obligate Anaerobier sind Organismen, die allein einen anaeroben Stoffwechsel betreiben und einen Lebensraum mit anoxischen Bedingungen brauchen. In der Mikrobiologie wird unterschieden zwischen moderaten Formen, die in Anwesenheit von Sauerstoff nicht wachsen können, und strikten Formen, die durch O2 geschädigt bzw. abgetötet werden.[1]
- Aerotolerante Anaerobier sind Organismen, die allein einen anaeroben Stoffwechsel betreiben, also O2 nicht nutzen, jedoch die Anwesenheit von Sauerstoff tolerieren und daher auch unter oxischen Bedingungen leben können.
- Fakultative Anaerobier sind Organismen, die unter sauerstofffreien Bedingungen einen anaeroben Stoffwechsel betreiben können, bei Anwesenheit von Sauerstoff aber O2 im Stoffwechsel nutzen können, also sowohl unter anoxischen Bedingungen wie unter oxischen Bedingungen wachsen können.
Lebensräume, in denen kein Sauerstoff enthalten ist, werden als anoxisch bezeichnet (mit früherem Sprachgebrauch auch als anaerob); Sauerstoff enthaltende Lebensräume werden oxisch genannt (früher auch aerob).
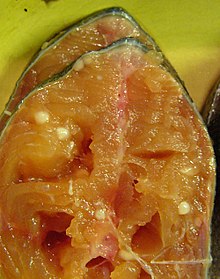
Das bis Februar 2020 einzig bekannte Tier (nach einer neuen Definition), das seine Energie ohne Mitochondrien bzw. Sauerstoff produziert, ist der kleine 10-zellige Lachsparasit Henneguya zschokkei, welcher im Laufe der Evolution die Fähigkeit zur Sauerstoffumwandlung (aerobe Zellatmung) verloren hat. Der Fund zeigt, dass auch mehrzellige Organismen ohne Sauerstoff bzw. Sauerstoffzellatmung überleben können und die Evolution zu scheinbar weniger komplexen Organismen führen kann.[2][3][4][5][6]
Anaerobe Atmung
[Bearbeiten | Quelltext bearbeiten]Im Unterschied zur aeroben Atmung werden bei der anaeroben für den oxidativen Energiestoffwechsel anstelle von O2 andere Elektronenakzeptoren als Oxidationsmittel verwendet. Häufig verwendete alternative Elektronenakzeptoren sind: Nitrat, dreiwertige Eisen-Ionen (Fe3+), vierwertige Mangan-Ionen (Mn4+), Sulfat, Schwefel, Fumarat und Kohlenstoffdioxid (CO2). Diese Redox-Reaktionen werden als anaerobe Atmung bezeichnet.
In der Tabelle sind Typen der anaeroben Atmung aufgeführt, die in der Umwelt weit verbreitet sind (zum Vergleich ist die aerobe Atmung mit dabei). Die Reihung der Atmungsprozesse erfolgte nach Möglichkeit nach dem Standard-Redoxpotential des Elektronenakzeptorpaars in Volt bei einem pH-Wert von 7. Die tatsächlichen pH-Werte können abweichen (z. B. bei Acetogenese).
| Atemtyp | Organismen | Elektronenakzeptor | Reaktionsprodukt(e) | Eo' [V][7] | Beispielorganismus |
|---|---|---|---|---|---|
| aerobe Atmung | obligate und fakultative Aerobier | Sauerstoff O2 | H2O + CO2 | + 0,82 | Eukaryoten |
| Nitratatmung (Denitrifikation) | fakultative Aerobier: Denitrifizierer | Nitrat NO3− | Nitrit NO2− | + 0,75 | Paracoccus denitrificans, E. coli |
| Manganreduktion | fakultative oder obligate Anaerobier | Mangan Mn(IV) | Mn(II) | + 0,41 | Desulfuromonadales, Desulfovibrio |
| Eisenatmung | fakultative Aerobier, obligate Anaerobier | Eisen Fe(III) | Fe(II) | + 0,15 | Geobacter, Geothermobacter, Geopsychrobacter, Pelobacter carbinolicus, P. acetylenicus, P. venetianus, Desulfuromonadales, Desulfovibrio |
| Cobaltreduktion | fakultative oder obligate Anaerobier | Kobalt Co(III) | Co(II) | Geobacter sulfurreducens | |
| Technetiumreduktion | fakultative oder obligate Anaerobier | Technetium Tc(VII) | Geobacter sulfurreducens, Geobacter metallireducens | ||
| Uranreduktion | fakultative oder obligate Anaerobier | Uran U(VI) | U(IV) | Geobacter metallireducens, Shewanella putrefaciens, (Desulfovibrio) | |
| Fumaratatmung | fakultative Aerobier | Fumarat | Succinat | + 0,03 | Escherichia coli |
| Sulfatatmung (Desulfurikation) | obligate Anaerobier: Sulfatreduzierer | Sulfat SO42− | Sulfid HS− | − 0,22 | Desulfobacter latus, Desulfovibrio |
| Methanogenese (Carbonatatmung) | methanogene und obligate Anaerobier: Methanbildner | Kohlenstoffdioxid CO2 | Methan CH4 | − 0,25 | Methanothrix thermophila |
| Schwefelatmung (Schwefelreduktion) | fakultative Aerobier und obligate Anaerobier | Schwefel S0 | Sulfid HS− | − 0,27 | Desulfuromonadales |
| Acetogenese (Carbonatatmung) | homoacetogene und obligate Anaerobier | Kohlenstoffdioxid CO2 | Acetat | − 0,30 | Acetobacterium woodii |
| TCA-Reduktion | fakultative oder obligate Anaerobier | TCA Trichloressigsäure | Dichloressigsäure | Trichlorobacter (Geobacteraceae) |
Gärung
[Bearbeiten | Quelltext bearbeiten]Nicht als anaerobe Atmung, sondern als Gärung werden Vorgänge bezeichnet, bei denen kein externer Stoff als terminaler Elektronenakzeptor verwendet wird. Gärungsorganismen sind vor allem:
- Milchsäurebakterien (Milchsäuregärung)
- Hefen (alkoholische Gärung)
- praktisch alle Aerobier beherrschen unter anoxischen Bedingungen die Milchsäuregärung: anaerober Stoffwechsel (beim Menschen siehe auch Anaerobe Schwelle)
Symbiosen
[Bearbeiten | Quelltext bearbeiten]Manche Turbellarien, Ringelwürmer und Enteroparasiten wie Bandwürmer[8][9] beherbergen anaerobe Bakterien und können durch diese Symbiose auch unter anoxischen Bedingungen leben.
Identifikation
[Bearbeiten | Quelltext bearbeiten]
Das Verhalten von Mikroorganismen gegenüber Sauerstoff, ihre Identifikation als Aerobier, Anaerobier, Aerotoleranter oder fakultativer Anaerobier, kann durch Kultur in einem Sauerstoffkonzentrationsgradienten ermittelt werden. Dabei kultiviert man sie in einem Gelnährmedium, das sich in einem einseitig geschlossenen Glasrohr (Reagenzglas, Kulturröhrchen) befindet und in das Sauerstoff nur vom oberen, offenen Ende durch Diffusion eindringen kann. Auf diese Weise bildet sich ein Sauerstoffkonzentrationsgradient aus mit hoher Sauerstoffkonzentration oben und niedriger Sauerstoffkonzentration unten. Die Mikroorganismen werden in sehr geringer Menge gleichmäßig im Gelnährmedium verteilt, in dem sie ortsgebunden sind und sich nicht fortbewegen können. Dort, wo sich die Mikroorganismen hinsichtlich der Sauerstoffkonzentration unter geeigneten Bedingungen befinden, vermehren sie sich und man kann nach einer gewissen Zeit einen Bewuchs mit bloßem Auge erkennen. Die Zone, in der sich Bewuchs zeigt, ist ein Indikator für das Verhalten der Mikroorganismen gegenüber Sauerstoff, wie aus dem Bild deutlich wird.
Kultur von anaeroben Mikroorganismen
[Bearbeiten | Quelltext bearbeiten]Anaerobie ist unter anderem bei der Kultivierung von Mikroorganismen von Bedeutung. Sollen gegenüber O2 empfindliche Mikroorganismen kultiviert werden oder sollen fakultativ anaerobe Mikroorganismen unter anoxischen Bedingungen kultiviert werden, so ist es erforderlich, bei der Kultur O2 auszuschließen. Hierbei werden sogenannte Anaerobentechniken verwendet. Ein Beispiel ist die Kultur in einer Anaerobenkammer: Darin erreicht man mit einer Gasatmosphäre aus 10 Vol.-% H2 + 10 Vol.-% CO2 + 80 Vol.-% N2 anoxische Bedingungen, die es ermöglichen, anaerobe Mikroorganismen zu kultivieren. Es besteht aber auch die Möglichkeit, anaerobe Mikroorganismen mittels Flüssigkulturen anzureichern. Dabei wird meist ausgenützt, dass die Löslichkeit von O2 in Flüssigkeiten mit steigender Temperatur sinkt.[10]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Anaerobier im Lexikon der Biologie auf spektrum.de; abgerufen am 13. Januar 2021.
- ↑ Nadja Podbregar: Forscher entdecken erstes Tier ohne aerobe Zellatmung - Zu den Nesseltieren gehörender Lachsparasit erzeugt Energie ohne Mitochondrien. In: scinexx.de. 26. Februar 2020, abgerufen am 16. März 2024.
- ↑ Klaus Taschwer: Forscher entdecken erstes Tier, das ganz ohne Sauerstoff leben kann. In: derstandard.de. 27. Februar 2020, abgerufen am 2. Februar 2024.
- ↑ Unique non-oxygen breathing animal discovered In: Science Daily, 25. Februar 2020. Abgerufen am 28. Februar 2020
- ↑ Veronique Greenwood: This Parasite Doesn't Need Oxygen to Survive In: The New York Times, 28. Februar 2020. Abgerufen am 21. März 2020
- ↑ Dayana Yahalomi, Stephen D. Atkinson, Moran Neuhof, E. Sally Chang, Hervé Philippe, Paulyn Cartwright, Jerri L. Bartholomew, Dorothée Huchon: A cnidarian parasite of salmon (Myxozoa: Henneguya) lacks a mitochondrial genome. In: Proceedings of the National Academy of Sciences. 117. Jahrgang, Nr. 10, 10. März 2020, ISSN 0027-8424, S. 5358–5363, doi:10.1073/pnas.1909907117, PMID 32094163, PMC 7071853 (freier Volltext) – (englisch).
- ↑ Johannes Ottow: Mikrobiologie von Böden. Biodiversität, Ökophysiologie und Metagenomik. Springer Verlag, Berlin 2011, ISBN 978-3-642-00823-8, S. 56.
- ↑ J. Zenka, Jan Prokopic: Contribution to the knowledge of aerobic processes in Taenia crassiceps larvae. In: Folia Parasitologica, Jg. 33 (1986), Heft 4, S 331–336, PMID 3804084.
- ↑ J. Zenka, Jan Prokopic: Malic enzyme, malate dehydrogenase, fumarate reductase and succinate dehydrogenase in the larvae of Taenia crassiceps (Zeder, 1800). In: Folia Parasitologica, Jg. 34 (1987), Heft 2, S. 131–136, PMID 3596392.
- ↑ Wagner, A. O., Markt, R., Mutschlechner, M., Lackner, N., Prem, E. M., Praeg, N., Illmer, P. Medium Preparation for the Cultivation of Microorganisms under Strictly Anaerobic/Anoxic Conditions. In: Journal of Visualized Experiments. 2019, doi:10.3791/60155.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- NZZ: Leben – gänzlich ohne Sauerstoff (abgerufen am 14. April 2010)