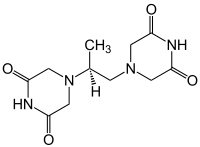
Dexrazoxan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Dexrazoxan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C11H16N4O4 | ||||||||||||||||||
| Kurzbeschreibung |
weiß bis grauweißes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Wirkmechanismus | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 268,27 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,3 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser und 0,1 N-Salzsäure, schwer löslich in Ethanol[3][4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Dexrazoxan ist ein Arzneistoff, der bei der Chemotherapie mit Anthracyclinen eingesetzt wird, um deren zytotoxische Wirkung zu mindern. Die Verbindung wurde 1964 entdeckt und findet seit den 1990er Jahren als Zytoprotektivum Anwendung. Die Bezeichnung leitet sich vom Racemat Razoxan ab, da Dexrazoxan dessen rechtsdrehendes Enantiomer (lateinisch dexter ‚rechts‘) darstellt. Während die zytoprotektive Wirkung auf die Fähigkeit zur Komplexbildung zurückgeführt wird, besitzt Dexrazoxan durch die Hemmung der Topoisomerase II auch eine bereits länger bekannte zytostatische Aktivität.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Dexrazoxan wurde, gemeinsam mit vergleichbaren Substanzen der Gruppe der bis-Dioxopiperazine, erstmals 1964 von Chemikern der J. R. Geigy AG beschrieben und zum Patent angemeldet. Unabhängig davon gelang Wissenschaftlern von Eastman Kodak gleiches ein Jahr später.[5] Zu diesem Zeitpunkt wurde es nicht nur zur pharmazeutischen Nutzung, sondern auch als Farbmittel in der Textilindustrie sowie als Zusatzstoff in Flugzeugtreibstoff in Betracht gezogen.[5] 1969 konnte ein Forscherteam erstmals eine zytostatische Aktivität von Dexrazoxan und ähnlichen Verbindungen nachweisen.[6] Drei Jahre später entdeckte man die herzschützende (kardioprotektive) Wirkung von Dexrazoxan, wobei dieser gewebespezifische Schutz mit einer Studie von 1983 um einen substanzspezifischen Schutz erweitert wurde: Es zeigte sich, dass Dexrazoxan insbesondere die zytotoxische Wirkung von Anthracyclinen mindern kann. In den späten 1980er und frühen 1990er Jahren wurde dieses protektive Spektrum um Zytostatika wie Cisplatin, Mitoxantron und Bleomycin erweitert,[7] jedoch haben diese Wirkungen keinen klinischen Stellenwert.
Chemie
[Bearbeiten | Quelltext bearbeiten]Bei Dexrazoxan handelt es sich um das isolierte (+)-(S)-Enantiomer des Racemats Razoxan, also des Gemisches, das Dexrazoxan und sein linksdrehendes Äquivalent zu gleichen Teilen enthält. Es gehört zur Gruppe der Bisdioxopiperazine und leitet sich von Piperazin ab.[8] Es ist besser wasserlöslich als Razoxan.[9] Durch Hydrolyse beider Ringstrukturen wird Dexrazoxan in seine biologisch aktive Form überführt, in der es sich als sowohl strukturelles als auch funktionelles Analogon von EDTA darstellt. Diese biologische aktive Form erhielt die Bezeichnung „ADR-925“ (ADR: adverse drug reaction, dt. etwa Arzneimittelnebenwirkung). Wie EDTA ist ADR-925 dann in der Lage, Chelatkomplexe, beispielsweise mit Eisenionen zu bilden (sowohl mit Fe2+ als auch Fe3+), wobei ADR-925 zwar als starker Chelatbildner gilt, Eisen jedoch um ein Vielfaches schwächer komplexiert als EDTA.[8]
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]Bei Dexrazoxan handelt es sich um ein Prodrug, das durch zwei Reaktionen in das biologisch aktive ADR-925 überführt wird. Im ersten Schritt wird der erste Ring durch eine Dihydropyrimidinase hydrolysiert, danach erfolgt die Spaltung des zweiten Rings durch eine Dihydroorotase.[10] Dieser Prozess geht schnell vonstatten, sodass innerhalb der ersten 15 Minuten nach intravenöser Gabe ein starker Konzentrationsanstieg von ADR-925 im Blut messbar ist. Der Abbau wiederum verläuft langsamer, so lässt sich vier Stunden nach intravenöser Gabe eine nahezu unveränderte Konzentration verzeichnen.[11] Die toxikologisch maximale tolerierbare Einzeldosis beträgt 1000 mg je kg Körpergewicht,[12] wobei Untersuchungen zeigten, dass Kinder eine höhere Toleranz für Dexrazoxan besitzen.[13]
Wirkung
[Bearbeiten | Quelltext bearbeiten]Die zuerst entdeckte zytostatische Wirkung von Dexrazoxan beruht auf einer Hemmung der Topoisomerase IIα.[14] Dieses Enzym lockert bzw. entwindet die Doppelhelix der DNA und ermöglicht somit die Replikation der Erbinformation und schließlich die Zellteilung. Dexrazoxan bindet an der N-terminalen-Domäne und verhindert dadurch die Bindung von ATP an das Enzym. In der Folge verliert die Topoisomerase ihre Funktionalität und die Zelle kann sich nicht teilen.[14]
Die allgemein zytoprotektive Wirkung von Dexrazoxan wird auf die Fähigkeit der Komplexbildung mit Eisen zurückgeführt. Anthracycline besitzen die Fähigkeit, Eisen nicht nur zu binden, sondern auch vom zweifach positiven Fe2+- zum dreifach positiven Fe3+-Ion zu oxidieren. Das Elektron wird dabei auf verschiedene Formen des Sauerstoffs übertragen; diese werden reduziert und es entstehen reaktive Sauerstoffspezies als Form von Radikalen. Jene Radikale sind als oxidativer Stress für zahlreiche zytotoxische Prozesse verantwortlich, beispielsweise für die Depolarisation der Mitochondrienmembranen am Herzmuskel. Dexrazoxan verhindert diese Prozesse durch die Komplexierung des Eisens.[11] Das an Dexrazoxan gebundene Eisen kann zwar ebenfalls zur Bildung von Radikalen führen, allerdings nur in weitaus geringerem Ausmaß als bei Anthracyclinen.[11]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Anthracycline wie Doxorubicin oder Epirubicin sind Zytostatika, die aufgrund ihres breiten Wirkungsspektrums bei einer Vielzahl von Krebserkrankungen im Rahmen der Chemotherapie eingesetzt werden. Dabei werden allerdings nicht nur entartete, sondern auch gesunde Zellen angegriffen, wobei sich diese unerwünschte Wirkung vor allem auf das Herz konzentriert. Die Folge dessen kann eine Kardiomyopathie mit sich anschließender irreversibler Herzinsuffizienz sein. Dexrazoxan kommt in diesem Zusammenhang seit den 1990er Jahren als FDA und EMA zugelassenes kardioprotektives Arzneimittel, meist in direkter Kombinationstherapie mit den Anthracyclinen, zum Einsatz.[15] Für die Primärprävention der anthracyclinbedingten Kardiotoxizität mit Dexrazoxane bei Kindern und Jugendlichen wurde am 19. Juli 2017 eine seit 2011 von der EMA ausgesprochene, vorübergehende Kontraindikation von Dexrazoxan als Kardioprotektivum für die pädiatrische Indikation wieder aufgehoben, da die klinischen Studien zeigten, dass durch Dexrazoxan weder die Antitumorwirkung von Anthracyclinen herabgesetzt, noch die Sekundärmalignizität erhöht wird.[16]
Seit 2006 ist der Wirkstoff zudem als Mittel zur Behandlung einer Anthracyclin-Paravasation zugelassen. Bei einer Paravasation kommt es bei der Infusion (in der Regel intravenös) zum Durchstechen des Blutgefäßes, sodass sich die Anthracycline im umliegenden Gewebe anreichern und für schwere Schäden wie Nekrosen oder Geschwüre sorgen. Studien zeigten, dass Dexrazoxan bei 98 % aller Patienten mit einer Paravasation eine Nekrosebildung verhindern konnte.[17]
Untersucht wird derzeit die Wirkung von Dexrazoxan und verwandten Substanzen bei der Behandlung von neurodegenerativen Erkrankungen wie Alzheimer oder Parkinson. Es wird davon ausgegangen, dass freies Eisen möglicherweise eine wesentliche Rolle bei der Pathogenese spielt und Arzneimittel, die Eisen binden, somit für eine Therapie in Frage kommen.[18]
Pharmazeutisch wird das wasserlösliche Dexrazoxanhydrochlorid eingesetzt. Die Verabreichung erfolgt als intravenöse Infusion.
Nebenwirkungen und Gegenanzeigen
[Bearbeiten | Quelltext bearbeiten]Dexrazoxan steht unter dem Verdacht, teratogen zu wirken, sodass Frauen und Männern bis zu drei Monate nach der Behandlung eine zuverlässige Empfängnisverhütung empfohlen wird.[19][15] Zudem wird vermutet, dass das Arzneimittel selbst kanzerogen wirkt, allerdings ist eine detailliertere Untersuchung dessen bisher nicht nötig, da es immer mit Anthracyclinen eingesetzt wird und diese Substanzen in diesem Verdacht bereits bestätigt sind.[20] Weitere mögliche Nebenwirkungen sind Neutro- und Thrombozytopenien, da Dexrazoxan eine Knochenmarksupression induziert, sowie Übelkeit, Erbrechen, Asthenie und Alopezie.[21]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Dexrazoxan ist in Europa und weiteren Ländern als Cardioxane oder Cyrdanax sowie in Nordamerika als Zinecard für die Milderung der kardiotoxischen Effekte erhältlich. Als Arzneimittel zur Behandlung der Paravasation wird es unter dem Namen Savene vertrieben.[15]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Kurt Hellmann, Walter Rhomberg: Razoxane and Dexrazoxane – Two Multifunctional Agents. Springer, New York u. a. 2010, ISBN 978-90-481-9167-3.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt Dexrazoxane bei Sigma-Aldrich, abgerufen am 28. März 2014 (PDF).
- ↑ Eintrag zu Dexrazoxane in der ChemSpider-Datenbank der Royal Society of Chemistry, abgerufen am 28. März 2014.
- ↑ a b Beschreibung zu Zinecard. rxlist.com; abgerufen am 31. März 2014.
- ↑ Pharmazeutische Stoffliste der ABDA-Datenbank (April 2014)
- ↑ a b Hellmann, Rhomberg: S. 1.
- ↑ A. M. Creighton, K. Hellmann, S. Whitecross: Antitumor activity in a series of bisdiketopiperazines. In: Nature, Band 222, Nummer 5191, S. 384–385, doi:10.1038/222384a0. PMID 5782118.
- ↑ Hellmann, Rhomberg: S. 4.
- ↑ a b Hellmann, Rhomberg: S. 160.
- ↑ Hellmann, Rhomberg: S. V (Preface).
- ↑ Hellmann, Rhomberg: S. 159.
- ↑ a b c Hellmann, Rhomberg: S. 161.
- ↑ Hellmann, Rhomberg: S. 169.
- ↑ Hellmann, Rhomberg: S. 176.
- ↑ a b Hellmann, Rhomberg: S. 162.
- ↑ a b c Datenblatt zu Dexrazoxan bei der Pharmazeutischen Zeitung; abgerufen am 8. April 2014.
- ↑ ema.europa.eu abgerufen am 7. Juni 2019
- ↑ H. T. Mouridsen, S. W. Langer u. a.: Treatment of anthracycline extravasation with Savene (dexrazoxane): results from two prospective clinical multicentre studies. In: Annals of Oncology, Band 18, Nummer 3, S. 546–550, doi:10.1093/annonc/mdl413, PMID 17185744.
- ↑ Hellmann, Rhomberg: S. 231.
- ↑ Hellmann, Rhomberg: S. 172.
- ↑ Hellmann, Rhomberg: S. 175.
- ↑ Rote-Hand-Brief zu Cardioxane, 18. Juli 2011, akdae.de (PDF; 244 kB) abgerufen am 8. April 2014.