Gramin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Gramin | ||||||||||||||||||
| Andere Namen |
1-(1H-Indol-3-yl)-N,N-dimethylmethanamin (IUPAC) | ||||||||||||||||||
| Summenformel | C11H14N2 | ||||||||||||||||||
| Kurzbeschreibung |
beiger geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 174,25 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
293,9 °C[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Gramin (auch Donaxin genannt) ist ein in verschiedenen Pflanzenarten vorkommendes Indol-Alkaloid. Gramin könnte eine Rolle in der Selbstverteidigung von Pflanzen spielen, weil es für verschiedene Organismen giftig ist.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Gramin wurde nachgewiesen in Getreidearten, wie Gerste, Blumenkohl, Silber-Pappel und bei Glanzgräsern.
Synthese
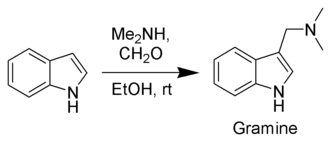
[Bearbeiten | Quelltext bearbeiten]Obwohl es in vielen verschiedenen Pflanzen vorkommt, ist Gramin viel einfacher direkt aus Indol über die Mannich-Reaktion mit Dimethylamin und Formaldehyd zu synthetisieren.
Auch der natürliche Bildungsweg innerhalb von Pflanzen sowie die zugehörigen Gene sind bekannt. Hierbei wird Gramin über zwei Zwischenschritte gebildet. Beim ersten Schritt wird aus der Aminosäure Tryptophan durch das Enzym AMI Synthase (Eine Cytochrom P450 Monooxygenase, ursprünglich als CYP76M57 bezeichnet) Aminomethylindol (AMI) gebildet. AMI wird durch eine N-Methyltransferase (NMT) zweimal methyliert, hierbei entsteht über das Zwischenprodukt N-Methylaminomethylindol Gramin.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Auf grasende Nutztiere wie z. B. Schafe[5] hat Gramin eine schädliche Wirkung, während es für Mäuse und Ratten nur eine geringe Toxizität aufweist[3].
Verwendung
[Bearbeiten | Quelltext bearbeiten]Gramin kann in der organischen Chemie als Ausgangsmaterial für die Tryptophan-Synthese verwendet werden.[6]
Alle Reaktionen von Gramin folgen dem gleichen allgemeinen Reaktionsschema:
- Gramin wird mit einer stark elektrophilen Substanz, wie z. B. Methyliodid versetzt, um ein quartäres Ammoniumsalz zu bilden
- Das Ammoniumsalz durchläuft eine Hofmann-Eliminierung oder eine Michael-Addition um das sehr aktive Zwischenprodukt 3 zu ergeben
- welches sich mit vielen verschiedenen nukleophilen Teilchen verbinden kann, um das gewünschte Produkt 4 zu ergeben

Literatur
[Bearbeiten | Quelltext bearbeiten]- L. J. Corcuera: Biochemical basis of the resistance of the barley to aphids. In: Phytochemistry 1993, 33, 741–747.
- Orechoff; Norkina: Chemische Berichte 1935, 68, 670.
- Pachter et al.: J. Org. Chem. 1959, 24, 1285.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Eintrag zu Gramin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b Europäisches Arzneibuch 10.0. Deutscher Apotheker Verlag, 2020, ISBN 978-3-7692-7515-5, S. 800.
- ↑ a b c d Eintrag zu Gramine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ Sara Leite Dias, Ling Chuang, Shenyu Liu, Benedikt Seligmann, Fabian L. Brendel, Benjamin G. Chavez, Robert E. Hoffie, Iris Hoffie, Jochen Kumlehn, Arne Bültemeier, Johanna Wolf, Marco Herde, Claus-Peter Witte, John C. D’Auria, Jakob Franke: Biosynthesis of the allelopathic alkaloid gramine in barley by a cryptic oxidative rearrangement. In: Science. Band 383, Nr. 6690, 29. März 2024, S. 1448–1454, doi:10.1126/science.adk6112.
- ↑ G.L. Marten, R.M. Jordan, A.W. Hovin: Biological significance of reed canarygrass alkaloids and association with palatability variation to grazing in sheep and cattle, Agronomy Journal 68 (1976), S. 909–914.
- ↑ N.F. Albertson, S. Archer, C.M. Suter: The Synthesis of Tryptophan from Gramine. In: J. Am. Chem. Soc. 67. Jahrgang, Nr. 1, 1945, S. 36–37, doi:10.1021/ja01217a010.
