Hydrierkatalysatoren
Hydrierkatalysatoren sind Katalysatoren, die die Anlagerung (Addition) von Wasserstoff ermöglichen, so dass es zur Hydrierung, das heißt der Reduktion von organischen Verbindungen, kommt. Es handelt sich hier normalerweise um Nebengruppenelemente. Vor allem die Platinmetalle wie Palladium und Platin haben große Bedeutung bei der Aktivierung von molekularem Wasserstoff, die der Anlagerung vorausgeht. Die große Bedeutung der Platinelemente resultiert aus der Tatsache, dass diese zwar eine Wechselwirkung mit molekularem Wasserstoff eingehen, aber keine Hydride bilden, sondern den Wasserstoff ungebunden in ihre Oktaederlücken oder Tetraederlücken einlagern. Von technischer Bedeutung sind hier vor allem die preiswerteren Elemente wie Nickel oder Eisen. Hydrierungen spielen in der organischen Synthese aber auch in der Lebensmittelindustrie (z. B. der Margarineherstellung) eine große Rolle.
Man unterscheidet zwischen der homogenen und der heterogenen Katalyse. Bei der homogenen Katalyse ist der Hydrierkatalysator vollständig im Lösungsmittel gelöst. Dies wird in durch den Einsatz von Liganden erreicht. Bei der heterogenen Katalyse liegt ein unlösliches Gemisch von Hydrierkatalysator und Lösungsmittel mit der zur hydrierenden Verbindung vor. Beim Einsatz von Salzen als Hydrierkatalysatoren wird im Allgemeinen zunächst das Salz reduziert und das fein verteilte Element bildet den aktiven Hydrierkatalysator.
Grundlagen
[Bearbeiten | Quelltext bearbeiten]Das nicht aktivierte Wasserstoffmolekül ist sehr reaktionsträge als Reduktionsmittel, da die Bindung zwischen den beiden Wasserstoffatomen recht stabil ist. Die Aufgabe des Hydrierkatalysators ist die Schwächung dieser Bindung und dadurch die Erhöhung der Reaktivität des Wasserstoffs. So wird eine Hydrierung bzw. Reduktion von funktionellen Gruppen mit Mehrfachbindungen ermöglicht.
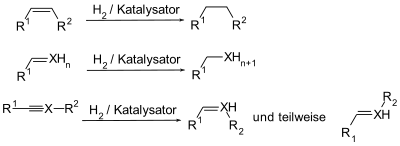
Die Katalysatormetalle müssen, um katalytisch aktiv zu sein, in fein verteilter Form vorliegen. Dies führt je nach Herstellungsprozess zu verschiedenen Katalysatoren mit unterschiedlichen Reaktivitäten und Selektivitäten bezüglich Substrat und Reaktionsbedingungen.
Katalysatoren der heterogenen Hydrierung
[Bearbeiten | Quelltext bearbeiten]Die Katalysatoren der heterogenen Hydrierung sind alle im Lösungsmittel der Hydrierung (organische Lösungsmittel wie Methanol, Dioxan oder Eisessig) unlöslich, weshalb es sich bei diesem Vorgang um eine heterogene Katalyse handelt. Katalysatoren der heterogenen Katalyse haben den Vorteil, dass sie leicht durch eine einfache Filtration aus dem Reaktionsgemisch zu entfernen sind.
Platin und Palladium
[Bearbeiten | Quelltext bearbeiten]Palladium und Platin sind, als Metall oder Oxid auf verschiedenen Trägermaterialien aufgezogen, die Hydrierkatalysatoren der ersten Wahl, da sie sehr vielseitig verwendbar sind. Sie sind stabil und verlieren wenig von ihrer Aktivität im Laufe der Zeit.
Die gängigsten Katalysatoren sind heute kommerziell erhältlich. Palladium und Platin unterscheiden sich in ihrer Aktivität wenig, jedoch ist Palladium durch verschiedene Herstellungsweisen modulierbarer als die vergleichbaren Platin-Katalysatoren. Im Folgenden eine Aufzählung der verschiedenen Katalysatoren, die sich in ihrer Herstellungsweise und dem Trägermaterial unterscheiden.
- Platinmohr[1]
- Adams-Katalysator (Platin(IV)-oxid)[2]
- Palladium auf Aktivkohle[3]
- Kolloides Palladium[4]
- Palladium(II)-oxid[5]
- Palladium auf Bariumsulfat[3]
- Palladium(II)-hydroxid auf Bariumsulfat[6]
- Lindlar-Katalysator (Palladium auf Calciumcarbonat und mit Blei(II)-acetat vergiftet)[7]
- Palladium auf Calciumcarbonat
- Palladiummohr[8]
Hervorzuheben aus der Liste ist der Lindlar-Katalysator. Der Katalysator ist mit Bleiacetat vergiftet. Dadurch ist es möglich, ein Alkin zu hydrieren, so dass dieses nur zum Alken und nicht zum Alkan reduziert wird. Man kann so, bedingt durch die syn-Addition des Wasserstoffs, bei der Hydrierung, Z-konfigurierte Alkene herstellen.

Rhodium und Ruthenium
[Bearbeiten | Quelltext bearbeiten]Die Katalysatoren auf Rhodium- oder Ruthenium-Basis sind vor allem aus ökonomischen Gründen im Vergleich zu Palladium oder Platin wesentlich weniger verbreitet.
Rhodium-Katalysatoren sind besonders für die Hydrierung von aromatischen Ringsystemen geeignet, da hier die Hydrierung häufig bei Raumtemperatur und Normaldruck gelingt.
Ruthenium-Katalysatoren werden vor allem bei der Reduktion von Aldehyden und Ketonen verwendet, da hier bei Normaldruck und Raumtemperatur Kohlenstoff-Kohlenstoff-Mehrfachbindungen nicht angegriffen werden.
Die Herstellung der Katalysatoren ist analog der Palladium- oder Platin-Katalysatoren abhängig von der Verwendung.
Als Einzelkatalysator wäre der Nishimura-Katalysator, der ein Rhodium-Platin-Mischoxid darstellt, zu erwähnen.[9][10]
Nickel
[Bearbeiten | Quelltext bearbeiten]Nickel gehört zu den preiswerten Hydrierkatalysatoren. In der Regel wird hier Raney-Nickel benutzt. Bedingt durch seine Herstellung trägt der Katalysator schon Wasserstoff auf der Metalloberfläche. Je nach Herstellungsweise werden mehr oder minder basische Nickelkatalysatoren erhalten, die als Raney-Nickel W 2, Raney-Nickel W 6 oder Raney-Nickel W 7 bezeichnet werden.[11][12] Als weiterer Nickel-Hydrierkatalysator ist Nickel, das auf Kieselgur aufgezogen wird, bekannt.[13]
Cobalt
[Bearbeiten | Quelltext bearbeiten]Cobalt-Katalysatoren[14] werden auf eine mit Raney-Nickel vergleichbare Weise hergestellt und werden daher auch als Raney-Cobalt bezeichnet.
Cobalt-Katalysatoren sind unreaktiver als Nickel-Katalysatoren, jedoch besonders geeignet zur Hydrierung von Nitrilen, da hier aufgrund der schlechten Reaktivität Kohlenstoff-Kohlenstoff-Mehrfachbindungen nicht angegriffen werden und so ungesättigte Amine hergestellt werden können.
Eisen
[Bearbeiten | Quelltext bearbeiten]Eisen-Katalysatoren[15] werden großtechnisch in der Regel als Festbett angewandt und beispielsweise durch Reduktion von Magnetit erhalten.[16] Sie haben im Vergleich zu Cobalt eine geringere Reaktivität. Großtechnisch sind Eisen-Katalysatoren von großer Bedeutung bei der Hydrierung von Adipodinitril zu Hexamethylendiamin. Im Laboratorium werden sie nur selten angewandt.
Kupferchromit und Zinkchromit
[Bearbeiten | Quelltext bearbeiten]Kupferchromit (CuCr2O4)[17][18][19] (Adkins-Katalysator) ist ein oxidischer Katalysator, da beim Kontakt von Katalysator und Wasserstoff wahrscheinlich zunächst fein verteiltes Kupfer(II)-oxid entsteht. Das Kupferchromit scheint das Oxid jedoch vor einer weiteren Reduktion zu elementarem Kupfer zu schützen, da reines Kupfer(II)-oxid sonst unter Hydrierbedingungen zu Kupfer reduziert wird.
Kupferchromit-Katalysatoren werden aufgrund ihrer Selektivität bei der Reduktion von Carbonylgruppen eingesetzt. Das Reduktionsvermögen gegenüber Kohlenstoff-Kohlenstoff-Doppelbindungen ist gering, aber vorhanden. Im Fall von α,β-ungesättigten Carbonylgruppen wird die Kohlenstoff-Kohlenstoff-Doppelbindung ebenfalls angegriffen. Hierzu sind jedoch Zinkchromit-Katalysatoren besser geeignet.[20] Bei α,β-ungesättigten Estern versagen dagegen beide. Aufgrund von Entwicklungen wie die Luche-Reduktion[21] haben diese Selektivitätsunterschiede heute jedoch ihre Bedeutung verloren.
Homogene Katalyse
[Bearbeiten | Quelltext bearbeiten]Die homogene Katalyse bei Hydrierungen hat vor allem eine Bedeutung bei der enantioselektiven Reduktion von prochiralen Gruppen wie geeignet substituierten Alkenen, unsymmetrischen Ketonen oder Iminen.
Alkene
[Bearbeiten | Quelltext bearbeiten]Der bekannteste und am weitesten verbreitete Katalysator in der homogenen katalytischen Hydrierung von Alkenen ist der Wilkinson-Katalysator, welcher aber aufgrund seiner eigenen Achiralität nicht enantioselektiv wirkt. Jedoch basieren die meisten chiralen Katalysatoren auf seiner Grundlage. Die Chiralität wird normalerweise durch die Wahl von chiralen Liganden festgelegt. Die Bedeutung der homogenen Katalyse wuchs mit den Arbeiten des späteren Nobelpreisträgers William Standish Knowles, welcher den Wilkinson-Katalysator durch die Verwendung von chiralen Phosphin-Liganden an Stelle der Triphenylphosphin-Liganden chiral modifizierte.[22] Die meisten chiralen Katalysatoren basieren auf der Grundlage dieser Arbeit. Mit dieser Modifikation ist das Enantiomerenverhältnis 15:1 erreicht worden. Das war in dem Jahr 1968 sehr gut. Kurze Zeit später wurde von Leopold Horner ein ähnliches Ergebnis erreicht.[23] Eine wichtige Entdeckung, welche die homogene Katalyse wertvoll für die Organische Chemie werden ließ, war die Entdeckung einer asymmetrischen Hydrierung der Kohlenstoff-Kohlenstoff-Doppelbindung in einer N-Acyldehydroaminosäure zu einer chiralen Zwischenstufe des Parkinson-Medikamentes L-DOPA durch Knowles.[24][25] Ein weiterer Fortschritt der homogenen katalytischen Hydrierung in der enantioselektiven Synthese war die Entdeckung des axialchiralen 2,2'–Bis(diphenylphosphino)–1,1'–binaphthyl-Liganden (BINAP) durch den ebenfalls, neben Knowles, mit dem Nobelpreis ausgezeichneten Ryoji Noyori.[26]
Ketone
[Bearbeiten | Quelltext bearbeiten]Die enantioselektive Reduktion von unsymmetrischen Ketonen ist von erheblicher Bedeutung.[27] Der dabei erzielte Enantiomerenüberschuss liegt häufig über 90 % oder gar 99 %.
Imine
[Bearbeiten | Quelltext bearbeiten]Zur enantioselektive Reduktion der Kohlenstoff-Stickstoff-Doppelbindung in prochiralen Iminen gibt es auch etablierte Verfahren.[28]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Felix Zymalkowski: Katalytische Hydrierung, Ferdinand Enke Verlag, Stuttgart 1965
Quellen
[Bearbeiten | Quelltext bearbeiten]- ↑ R. Willstätter, E. Waldschmidt-Leitz: In Ber. dtsch. chem. Ges. 1921, 54, 121.
- ↑ R. Adams, V. Voorhees, R.L. Shriner: Platinum Catalyst for Reductions In: Organic Syntheses. 8, 1928, S. 92, doi:10.15227/orgsyn.008.0092; Coll. Vol. 1, 1941, S. 463 (PDF).
- ↑ a b R. Mozingo: Palladium Catalysts In: Organic Syntheses. 26, 1946, S. 77, doi:10.15227/orgsyn.026.0077; Coll. Vol. 3, 1955, S. 685 (PDF).
- ↑ A. Skita: In Ber. dtsch. chem. Ges. 1912, 45,3584
- ↑ D. Starr; R.M. Hixon: Tetrahydrofuran In: Organic Syntheses. 16, 1936, S. 77, doi:10.15227/orgsyn.016.0077; Coll. Vol. 2, 1943, S. 566 (PDF).
- ↑ R. Kuhn, H.J. Haas: In Angew. Chem. 1955, 67, 785.
- ↑ H. Lindlar: In Helv. chim. Acta, 1952, 35, 446 und Österr. Pat. 168606, F. Hoffmann-La Roche & Co. AG.
- ↑ R. Willstätter, E. Waldschmidt-Leitz: In Ber. dtsch. chem. Ges. 1921, 54,121.
- ↑ S. Nishimura: In Bull. Chem. Soc. Jpn. 1961, 34, 1544.
- ↑ S. Nishimura, T. Onoda, A. Nakamura: In Bull. Chem. Soc. Jpn. 1960, 33, 1356.
- ↑ R. Mozingo: Catalyst, Raney Nickel W-2 In: Organic Syntheses. 21, 1941, S. 15, doi:10.15227/orgsyn.021.0015; Coll. Vol. 3, 1955, S. 181 (PDF).
- ↑ H.R. Billica, H. Adkins: Catalyst, Raney Nickel, W-6 In: Organic Syntheses. 29, 1949, S. 24, doi:10.15227/orgsyn.029.0024; Coll. Vol. 3, 1955, S. 176 (PDF).
- ↑ L.W. Covert, R. Connor, H. Adkins, J. Am. Chem. Soc. 1932, 54, 1651.
- ↑ Amer. Pat. 2166183, Du Pont
- ↑ R. Paul, G. Hilly: In Bull. Soc. chim. France 1939, 6, 218.
- ↑ Deutsches Patent DE 101 51 559
- ↑ W. A. Lazier, H. R. Arnold: Copper chromite catalysts In: Organic Syntheses. 19, 1939, S. 31, doi:10.15227/orgsyn.019.0031; Coll. Vol. 2, 1943, S. 142 (PDF).
- ↑ R. Connor, W. Folkers, H. Adkins: In J. Am. Chem. Soc. 1931, 53, 2012
- ↑ R. Connor, W. Folkers, H. Adkins: In J. Am. Chem. Soc. 1932, 54, 1138.
- ↑ H. Adkins, E.E. Burgoyne, H. J. Schneider: In J. Am. Chem. Soc. 1950, 72, 2626.
- ↑ C. R. Johnson, B. D. Tait in: J. Org. Chem. 1987, 52, 281–283.
- ↑ W. S. Knowles, M. J. Sabacky: In J. Chem. Soc., Chem. Commun. 1968, 1445–1446.
- ↑ L. Horner, H. Buethe, H. Siegel: In Tetrahedron Lett. 1968, 4023.
- ↑ B. D. Vineyard, W. S. Knowles, M. J. Sabacky, G. L. Bachmann, D. J. Weinkauff: In J. Am. Chem. Soc. 1977, 99, 5946–5952.
- ↑ W. S. Knowles: In Acc. Chem. Res. 1983, 16, 106–112
- ↑ A. Miyashita, A. Yasuda, H. Takaya, K. Toriumi, T. Ito, T. Souchi, R.Noyori: In J. Am. Chem. Soc. 1980, 102, 7932.
- ↑ Sabine Wallbaum und Jürgen Martens: Asymmetric Syntheses with Chiral Oxazaborolidines, In: Tetrahedron: Asymmetry 3 (1992) 1475–1504.
- ↑ Jürgen Martens: Reduction of Imino Groups (C=N) in (G. Helmchen, R. W. Hoffmann, J. Mulzer, E. Schaumann) Houben-Weyl Stereoselective Synthesis, Workbench Edition E21 Volume 7, S. 4199–4238, Thieme Verlag Stuttgart, 1996.