Metall-Metall-Bindung
Eine Metall-Metall-Bindung im engeren Sinne ist eine gerichtete chemische Bindung zwischen einzelnen Metallatomen. Im Gegensatz dazu ist die metallische Bindung eine ungerichtete Bindung zwischen vielen Metallatomen.
Die Metall-Metall-Bindung im engen Sinne kommt durch ein oder mehrere gemeinsame Elektronenpaare zustande und ist daher eine Elektronenpaarbindung. Je nach Zahl der bindenden Elektronenpaare (eins, zwei, drei, vier oder fünf) handelt es sich um eine Einfach-, Doppel-, Dreifach-, Vierfach- oder Fünffachbindung.
Verbindungen mit Metall-Metall-Bindung, insbesondere wenn sie mehr als zwei verbundene Metallatome haben, werden auch als Metallcluster bezeichnet.
Beispiele
[Bearbeiten | Quelltext bearbeiten]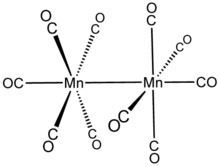
- Einfachbindung: [Mn2(CO)10], [Re2(CO)10], [Mo2Cl9]3−. Auch im Dieisennonacarbonyl [Fe2(CO)9] liegt nach[1] eine Metall-Metall-Einfachbindung vor, wobei es aber Argumente gegen diese Bindung gibt.[2]
- Doppelbindung: [Re3Cl9] im Rhenium(III)-chlorid[3]
- Dreifachbindung: [W2Cl9]3−
- Vierfachbindung: [Re2Cl8]2−, Octamethyldimetallat-Anionen: [Cr2Me8]4−, [Mo2Me8]4−, [W2Me8]4−
- Fünffachbindung: z. B. zwischen Chrom- oder Uranatomen
- Sechsfachbindung: wird für die Bindung in den zweiatomigen Molekülen Dimolybdän Mo2 und Diwolfram W2 diskutiert.
Einwertige Verbindungen von Quecksilber und verwandte Strukturen
[Bearbeiten | Quelltext bearbeiten]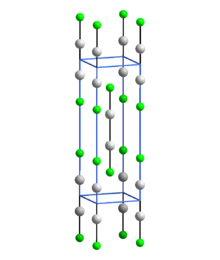
Alle Quecksilber(I)-Verbindungen, z. B. die Halogenide Quecksilber(I)-fluorid Hg2F2, Quecksilber(I)-chlorid Hg2Cl2, Quecksilber(I)-bromid Hg2Br2 und Quecksilber(I)-iodid Hg2I2, sowie das einwertige Quecksilber(I)-oxid Hg2O und das Quecksilber(I)-nitrat Hg2(NO3)2, enthalten eine Anordnung von zwei aneinander gebundenen Quecksilberatomen, d. h. eine Hg–Hg-Bindung. Mit den daran gebundenen Liganden (L z. B. F, Cl, Br, I) wird eine lineare, d. h. auf einer Geraden liegende, Struktur L–Hg–Hg–L gebildet.
Es sind auch Quecksilberpolykationen bekannt, die aus Ketten von aneinander gebundenen Hg-Atomen bestehen, die insgesamt zwei positive Ladungen tragen, wie das Hg32+.
Bei Zink und Cadmium ist die einwertige Oxidationsstufe weniger stabil und daher seltener. Bei erhöhter Temperatur hat ein Gemisch aus Zink und ZnCl2 eine erhöhte Flüchtigkeit, was durch die Gegenwart von Zn2Cl2 erklärt wird. Einwertiges Cadmium ist im Chloroaluminat Cd2[AlCl4]2 enthalten.[4]
Metalldämpfe
[Bearbeiten | Quelltext bearbeiten]Lithiumdampf enthält etwa 1 % Li2-Moleküle[5], Natriumdampf etwa 16 % Na2-Moleküle.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1785.
- ↑ Jee Hwan Jang, Jung Goo Lee, Hosull Lee, Yaoming Xie, Henry F. Schaefer III: Molecular Structures and Vibrational Frequencies of Iron Carbonyls: Fe(CO)5, Fe2(CO)9, and Fe3(CO)12. In: The Journal of Physical Chemistry A. Band 102, Nr. 27, 1998, S. 5298–5304, doi:10.1021/jp981356o.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1626–1627.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1495.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1260.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1273.