Mycophenolat-Mofetil
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
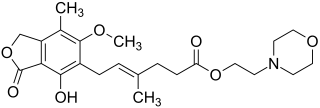
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Mycophenolat-Mofetil | |||||||||||||||||||||
| Andere Namen |
(E)-6-(-4-Hydroxy-6-methoxy-7-methyl-3-oxo-1,3-dihydroisobenzofuran-5-yl)-4-methylhex-4-ensäure-2-morpholinoethylester (IUPAC) | |||||||||||||||||||||
| Summenformel | C23H31NO7 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes bis fast weißes, kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 433,50 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, leicht löslich in Aceton, wenig löslich in absolutem Ethanol[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Mycophenolat-Mofetil (auch Mykophenolatmofetil oder Mykophenolat-Mofetil, MMF) ist ein Arzneistoff, der die Wirkung des Immunsystems unterdrückt (Immunsuppressivum). Es wird vor allem in Kombination mit Ciclosporin und Corticosteroiden zur Prophylaxe von akuten Transplantatabstoßungsreaktionen bei Patienten mit allogener Nieren-, Herz- oder Lebertransplantation eingesetzt.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Mycophenolat-Mofetil wurde von dem Pharmazieunternehmen Syntex entwickelt. Nach der Übernahme durch Roche wurde es im Mai 1995 unter dem Namen CellCept in den USA zugelassen. In Europa war es eines der ersten Medikamente, das in einem zentralen Zulassungsverfahren für 15 Länder zugelassen wurde.
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]Wirkungsmechanismus
[Bearbeiten | Quelltext bearbeiten]Mycophenolat-Mofetil ist der 2-Morpholinoethylester der Mycophenolsäure (MPA) und wird im Körper in diese umgewandelt. MPA ist ein selektiver, nicht-kompetitiver und reversibler Hemmer der Inosinmonophosphat-Dehydrogenase (IMPDH), der daher die Synthese der Guanin-enthaltenen Nukleotide (Guanosin) hemmt. Da für die Proliferation von T- und B-Lymphozyten die De-novo-Synthese von Purinen unerlässlich ist, während andere Zellarten den Wiederverwertungsstoffwechsel benutzen können, wirkt MPA stärker zytostatisch auf Lymphozyten als auf andere Zellen, wodurch diese selektiv gehemmt werden.
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Mycophenolat-Mofetil hat zahlreiche Nebenwirkungen. Häufigere Nebenwirkungen (bei über 10 % der Patienten) sind Anämie, Thrombozytopenie, Übelkeit, Erbrechen und Durchfall. Infolge der Unterdrückung des Immunsystems können vermehrt Infektionen (Sepsis, Candidose, Herpes simplex, Herpes zoster) auftreten.
Mycophenolsäurepräparate sind teratogen. Über dieses schwerwiegende Risiko informierten Roche im November 2007[4] und im November 2015[5] und Novartis im Februar 2016[6] in Rote-Hand-Briefen.
In einigen Fällen wurde eine Progressive multifokale Leukenzephalopathie (PML) als lebensbedrohliche, neurologische Nebenwirkung beobachtet.[7]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]CellCept (EU, CH) und diverse Generika
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Artikel aus dem Ärzteblatt (22. März 1996) über die Zulassung von CellCept
- FDA Information
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag MYCOPHENOLATE MOFETIL CRS beim Europäisches Direktorat für die Qualität von Arzneimitteln (EDQM), abgerufen am 15. August 2008.
- ↑ a b Eintrag zu Mycophenolatmofetil. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Oktober 2014.
- ↑ a b Datenblatt Mycophenolate mofetil, ≥98% (HPLC) bei Sigma-Aldrich, abgerufen am 31. Oktober 2016 (PDF).
- ↑ Rote-Hand-Brief von Roche auf der Website der Arzneimittelkommission der deutschen Ärzteschaft, abgerufen am 13. März 2022.
- ↑ Rote-Hand-Brief von Roche auf der Website der Arzneimittelkommission der deutschen Ärzteschaft, abgerufen am 13. März 2022.
- ↑ Rote-Hand-Brief von Novartis auf der Website der Arzneimittelkommission der deutschen Ärzteschaft, abgerufen am 1. März 2016.
- ↑ Rote-Hand-Brief zu CellCept, 18. Februar 2008 (PDF; 111 kB).