Shunt (Medizin)
Als Shunt (englisch für „Verschiebung“, „Nebenschluss“, „Weiche“; Aussprache: []) wird in der Medizin eine Kurzschlussverbindung mit Flüssigkeitsübertritt zwischen normalerweise getrennten Gefäßen oder Hohlräumen bezeichnet. Diese kann natürlich vorkommen (z. B. im Rahmen von Fehlbildungen wie arteriovenösen Malformationen) oder auch im Rahmen einer medizinischen Maßnahme künstlich angelegt werden.
Hinweise zur Therapie finden sich bei den Stichwörtern Atriumseptumdefekt und Ventrikelseptumdefekt.
Embryonale Shunts
[Bearbeiten | Quelltext bearbeiten]Während der Embryonal- und Fetalzeit des Kindes existieren drei Shunts. Der Lebershunt, der Aortenshunt und der Vorhofshunt. Diese drei Shunts sind im Embryonalkreislauf nötig, da das Kind sich nicht selbst durch Atmen mit Sauerstoff versorgen kann. Solange die Lungen kollabiert sind, ist das Kind auf den Sauerstoff angewiesen, der durch die Plazenta bereitgestellt wird. Die Shunts verschließen sich nach der Geburt. Allerdings können durch Nichtverschließung verschiedene Herzfehler entstehen, die man operativ beheben kann.
Lebershunt
[Bearbeiten | Quelltext bearbeiten]Der Lebershunt ist dadurch charakterisiert, dass die Nabelvene (Vena umbilicalis) den Leberkreislauf umgeht, in dem sie sich durch den Ductus venosus (auch Ductus Arantii genannt) mit der unteren Hohlvene (Vena cava inferior) verbindet, und somit direkt zum Herzen geht. Dies hat zur Folge, dass im Kinderherzen gemischtes Blut, also sauerstoffarmes (aus der Vena cava inferior) und sauerstoffreiches (aus der Nabelvene), ankommt. Der Sauerstoff- und Nährstoffgehalt des Blutes der Nabelvene wird jedoch aufgrund des Lebershunts weit weniger gesenkt als es ohne den Shunt der Fall wäre, so dass der Sauerstoffgehalt des Mischblutes für die kindliche Versorgung noch ausreicht.
Vorhofshunt
[Bearbeiten | Quelltext bearbeiten]Während der Herzentwicklung wird der Herzschlauch kranial bei den Bluteinstrombahnen mittig durch Herzscheidewände geteilt. Diese Teilung durch Gewebe nennt man Septierung. Zuerst entsteht ein Septum primum, das den gemeinsamen Vorhof in einen rechten und linken teilt. Bei dieser Vorhofteilung bleibt allerdings ein Foramen primum („erstes Loch“). Dieses Loch ist nahe dem Endokardkissen, das medial im Herzen liegt. Dieses Loch verschließt sich und ein neues Loch entsteht: das Foramen secundum oder Foramen ovale. Wichtig ist, dass das Foramen ovale im Septum primum gebildet wird. Das Foramen ovale wird durch eine Art Vorhang verschlossen, das Septum secundum. Dieses Septum entsteht auf der rechten Herzhälfte, gehört also zum rechten Vorhof. Dieses Septum garantiert den Blutdurchfluss vom rechten Vorhof in den linken, wobei ein Blutaustausch vom linken Vorhof in den rechten unterbunden wird. Das Foramen ovale bildet somit den Vorhofshunt, um das gemischte Blut aus der Vena cava inferior in den linken Vorhof zu führen, so dass das linke Herz den Körper mit sauerstoffreicherem Blut versorgen kann.
Aortenshunt
[Bearbeiten | Quelltext bearbeiten]Da die Lungen noch nicht funktionsfähig und kollabiert sind, wird die Lunge durch den Ductus arteriosus (oder auch Ductus Botalli) umgangen. Ausgehend vom Truncus pulmonalis geht der Ductus Botalli zur Aorta. Allerdings führt der Ductus Botalli das sauerstoffarme Blut aus dem rechten Ventrikel erst dann zur Aorta, wenn die A. carotis communis und die A. subclavia abgegangen sind. Somit bekommen das Gehirn und die Arme das sauerstoffreichste Blut, der Rest des Körpers wird mit sauerstoffärmerem Blut versorgt.
Hämodynamische Shunts
[Bearbeiten | Quelltext bearbeiten]Symptome
[Bearbeiten | Quelltext bearbeiten]- Ein hämodynamischer Shunt (oder Kreislauf-Shunt) kann die Druckverhältnisse in den Blutgefäßen maßgeblich verändern. So kann zum Beispiel ein Shunt im Rahmen eines Ventrikelseptumdefektes den erreichbaren Blutdruck begrenzen.
- Auch kann durch einen Shunt die Sauerstoffsättigung des Bluts durch Vermischung vermindert sein. Da das Verhältnis von Sättigung zu Partialdruck nicht linear, sondern sigmoid ist, kann dies eine Unterversorgung des Organismus zur Folge haben.
Shunt zwischen großem und kleinem Kreislauf
[Bearbeiten | Quelltext bearbeiten]Bei den Kreislaufshunts unterscheidet man zwischen einem Links-rechts-Shunt, bei dem arterialisiertes Blut unter Umgehung der peripheren Kapillaren wieder ins venöse System zurückfließt, und einem Rechts-links-Shunt, bei dem sauerstoffarmes Blut in die Körperarterien gelangt.[1][2]
Klinisch bedeutsam sind solche Kurzschlussverbindungen zwischen dem von der rechten Herzhälfte ausgehenden Lungenkreislauf und dem von der linken Herzhälfte ausgehenden Körperkreislauf bei angeborenen Herzfehlern (Vorhofseptumdefekt und Kammerseptumdefekt) oder bei anderen Entwicklungsstörungen wie z. B. dem persistierenden Ductus arteriosus (offener Ductus arteriosus Botalli) oder einem persistierenden Foramen ovale (PFO). Entsprechend dem höheren Druck im Körperkreislauf des linken Herzens besteht zunächst immer ein Links-rechts-Shunt; kommt es durch die Dauerbelastung des rechten Herzens zu einer strukturellen Veränderung desselben, kann es zu einer Shunt-Umkehr mit nachfolgendem Rechts-links-Shunt kommen. Dieser Prozess wird Eisenmenger-Reaktion (mit resultierendem Eisenmenger-Syndrom) genannt.[3] Die erste operative Behandlung eines durch einen offenen Ductus arteriosus bedingten Links-rechts-Shunts in Deutschland erfolgte 1939 durch Emil Karl Frey.[4]
Beim Rechts-links-Shunt ist das Herzzeitvolumen größer als das Lungenzeitvolumen, beim Links-rechts-Shunt ist das Herzzeitvolumen kleiner als das Lungenzeitvolumen. Als Shunt-Volumen bezeichnet man das pro Zeitspanne durch einen Shunt fließende Blutvolumen.[5] Allgemein gilt für bidirektionale Shunts: Herzzeitvolumen + Links-rechts-Shuntvolumen = Lungenzeitvolumen + Rechts-links-Shuntvolumen.[6][7] Deswegen gilt beim Links-rechts-Shunt, wenn das Rechts-links-Shuntvolumen gleich null ist: „Großes Minutenvolumen im kleinen Kreislauf → kleines Minutenvolumen im großen Kreislauf“.[8] Die Differenz zwischen dem Bruttoschlagvolumen und dem Nettoschlagvolumen bezeichnet man auch als Shuntvolumen, Regurgitation oder Kurzschlussblut.[9] Das entstehende Mischblut heißt Shunt-Blut;[10] es kommt zur Mischungscyanose.[11] In sehr schweren Fällen ist das Lungenzeitvolumen bis zu dreimal so groß wie das Herzzeitvolumen.[12] Nach einer Shuntumkehr kann bei Eisenmenger-Patienten das Rechts-links-Shuntvolumen bis zu 6,8 l/min betragen.[13]
In der Physiologie der Atmung unterscheidet man folgende Shuntformen.[14] Beispiele:
- Physiologischer Shunt: die venöse Beimischung im sauerstoffangereicherten Blut (etwa 2 bis 5 % des Herzzeitvolumens)[15]
- Anatomischer bzw. pathologischer Shunt: venöse Beimischung aus Blutgefäßen zwischen großem und kleinem Blutkreislauf
- Funktioneller Shunt: venöse Beimischung aus nicht oder schlecht belüfteten Alveolen
- intrapulmonaler Shunt zwischen Venen und Arterien im Lungenkreislauf unter Umgehung der Alveolen
Angeborene arteriovenöse Shunts der peripheren Gefäße nennt man AV-Malformation. Hierbei handelt es sich um eine angeborene Gefäßverbindung zwischen einer Arterie und einer Vene ohne dazwischen liegendem Kapillarbett. Iatrogen können Kurzschlussverbindungen (AV-Fistel) auch im Rahmen der Punktion einer Arterie versehentlich durch eine Vene hindurch, beispielsweise im Rahmen einer Herzkatheteruntersuchung, entstehen.
Shunt-Operationen am Herzen
[Bearbeiten | Quelltext bearbeiten]Bei bestimmten angeborenen Herzfehlern wird ein künstlicher Shunt zwischen arteriellem und venösem Kreislauf angelegt, um die Sauerstoffversorgung des Patienten zu verbessern. Der klassische Shunt ist die Blalock-Taussig-Anastomose. In vielen Fällen wird dieser Shunt im Rahmen einer Korrektur- oder einer weiteren Palliativoperation des Herzfehlers wieder entfernt.
Dialyseshunts
[Bearbeiten | Quelltext bearbeiten]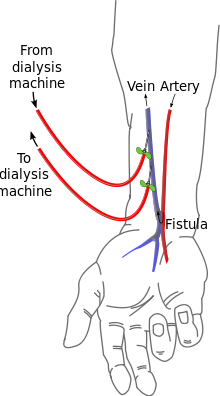
Bei Dialysepatienten wird künstlich ein Shunt (oder auch arteriovenöse Fistel) angelegt, um ein großvolumiges Blutgefäß zur Verfügung zu haben, mit dem man eine Hämodialyse durchführen kann. Dieses Verfahren wurde 1960 von Belding Scribner entwickelt.
Die bevorzugte Lokalisation für einen Dialyseshunt ist die Verbindung zwischen der Arteria radialis und der Vena cephalica am Unterarm. Dieser Shunt wird nach den Erstbeschreibern auch Cimino-Brescia-Shunt genannt. Weitere Möglichkeiten für einen Dialyseshunt am Oberarm sind die Verbindungen der mobilisierten und unter die Haut verlagerten Vena basilica mit der Arteria brachialis (sogenannter Basilica-Shunt) oder zwischen Vena cephalica und Arteria brachialis (sogenannter Cephalica-Shunt).
Dialyseshunts sind für Patienten mit einer schweren Nierenfunktionsstörung (Niereninsuffizienz) überlebenswichtig.
Bei Infektionen von Shunts erfolgt eine gezielte bzw. empirische antimikrobielle Therapie.[16]
Ventrikulo-peritonealer Shunt
[Bearbeiten | Quelltext bearbeiten]Ein sogenannter ventrikulo-peritonealer Shunt (VP-Shunt) ist eine in der Neurochirurgie operativ angelegte permanente Ableitung des Liquors bei einem Hydrocephalus. Dabei wird ein Schlauch von der Schädeldecke her unter der Haut durch den Hals hinab vor der Brustwand bis zur Bauchfellhöhle (Peritonealhöhle) geführt. Es gibt VP-Shunts, die ein von außen verstellbares Ventil besitzen, um den Abfluss dem Bedarf anzupassen.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Lutz Steinmüller, Marc Olaf Liedke, Margret Liehn: Shunt- und Portsysteme. In: Margret Liehn, Brigitte Lengersdorf, Lutz Steinmüller, Rüdiger Döhler (Hrsg.): OP-Handbuch. Grundlagen, Instrumentarium, OP-Ablauf. 6., aktualisierte und erweiterte Auflage. Springer, Berlin / Heidelberg / New York 2016, ISBN 978-3-662-49280-2, S. 321–327.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Stefan Silbernagl, Florian Lang: Taschenatlas der Pathophysiologie. Georg Thieme Verlag, Stuttgart/ New York, ISBN 3-13-102191-8, und Deutscher Taschenbuch-Verlag, München 1988, ISBN 3-423-03236-7, S. 202.
- ↑ Frank Henry Netter: Farbatlanten der Medizin, 4. Band, Atmungsorgane, Georg Thieme Verlag, Stuttgart / New York 1982, ISBN 3-13-524301-X, S. 68 f.
- ↑ Franz Grosse-Brockhoff, Franz Loogen, Adalbert Schaede: Untersuchungsmethoden bei Herzfehlern, in: Handbuch der inneren Medizin, 4. Auflage, 9. Band, 2. Teil, Springer-Verlag, Berlin / Göttingen / Heidelberg 1960, S. 1242–1287, hier S. 1246 f.
- ↑ Friedrich Wilhelm Hehrlein: Herz und große Gefäße. In: Franz X. Sailer, F. W. Gierhake (Hrsg.): Chirurgie historisch gesehen: Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 164–185, hier: S. 172.
- ↑ Willibald Pschyrembel: Klinisches Wörterbuch. 266. Auflage. Verlag Walter de Gruyter, Berlin 2014, ISBN 978-3-11-033997-0, S. 1958
- ↑ Otto Martin Hess, Rüdiger W. R. Simon: Herzkatheter: Einsatz in Diagnostik und Therapie. Springer, 2013, ISBN 978-3-642-56967-8, S. 17 (google.de).
- ↑ Günter Thiele (Hrsg.): Handlexikon der Medizin. Urban & Schwarzenberg, München / Wien / Baltimore 1980, 4 Bände, Band 4, S. 2241
- ↑ Gerd Herold: Innere Medizin 2019. Selbstverlag, Köln 2018, ISBN 978-3-9814660-8-9, S. 186.
- ↑ Herbert Reindell, Karl Musshoff, Helmut Klepzig: Größen- und Formänderung des Herzens. In: Handbuch der inneren Medizin. 4. Auflage. 9. Band, 1. Teil. Springer-Verlag, Berlin / Göttingen / Heidelberg 1960, S. 887.
- ↑ Brockhaus Enzyklopädie, 19. Auflage, Verlag F. A. Brockhaus, Mannheim 1993, 20. Band, ISBN 3-7653-1120-0, S. 221.
- ↑ Franz Grosse-Brockhoff, Franz Loogen, Adalbert Schaede: Angeborene Herz- und Gefäßmißbildungen, in: Handbuch der inneren Medizin, 4. Auflage, 9. Band, 3. Teil, Springer-Verlag, Berlin / Göttingen / Heidelberg 1960, S. 105–652, hier S. 226.
- ↑ Franz Grosse-Brockhoff, Franz Loogen, Adalbert Schaede: Angeborene Herz- und Gefäßmißbildungen, in: Handbuch der inneren Medizin, 4. Auflage, 9. Band, 3. Teil, Springer-Verlag, Berlin / Göttingen / Heidelberg 1960, S. 105–652, hier S. 239. Zitat: „während das Lungenzirkulationsvolumen einmal bis dreimal so groß wie das Minutenvolumen des großen Kreislaufs war“.
- ↑ Franz Grosse-Brockhoff, Franz Loogen, Adalbert Schaede: Angeborene Herz- und Gefäßmißbildungen, in: Handbuch der inneren Medizin, 4. Auflage, 9. Band, 3. Teil, Springer-Verlag, Berlin / Göttingen / Heidelberg 1960, S. 105–652, hier S. 238.
- ↑ Thomas Pasch, S. Krayer, H. R. Brunner: Definition und Meßgrößen der akuten respiratorischen Insuffizienz: Ventilation, Gasaustausch, Atemmechanik. In: J. Kilian, H. Benzer, F. W. Ahnefeld (Hrsg.): Grundzüge der Beatmung. Springer, Berlin u. a. 1991, ISBN 3-540-53078-9, 2., unveränderte Aufl. ebenda 1994, ISBN 3-540-57904-4, S. 95–108; hier: S. 98–100.
- ↑ Willibald Pschyrembel: Klinisches Wörterbuch, 268. Auflage, Verlag Walter de Gruyter, Berlin / Boston 2020, ISBN 978-3-11-068325-7, S. 1632.
- ↑ Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 72 f. (Shunt-Infektionen).