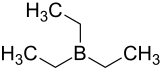
Triethylboran
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Triethylboran | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H15B | |||||||||||||||
| Kurzbeschreibung |
selbstentzündliche, farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 98,00 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,696 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
95 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
Hydrolyse in Wasser[1] | |||||||||||||||
| Brechungsindex |
1,397 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Triethylboran ist eine chemische Verbindung aus der Stoffklasse der bororganischen Verbindungen.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Triethylboran kann durch Reaktion von Boran mit Ethen gewonnen werden. Als Quelle für das Boran dient Diboran oder ein Tetrahydrofuran-Boran-Additionsprodukt.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Triethylboran ist eine selbstentzündliche, leicht flüchtige, farblose Flüssigkeit, bei welcher die Hydrolyse mit Wasser erfolgt. Sie zersetzt sich bei Erhitzung.[1] Das technische Produkt wird auch als Lösung mit Tetrahydrofuran, Hexan oder Diethylether ausgeliefert.[2][4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Triethylboran wird in der Lackindustrie und bei organischen Synthesen verwendet.[1] Es wird zusammen mit Lithium-tert-butoxyaluminiumhydrid für die reduktive Spaltung von Ethern oder Epoxiden eingesetzt. Es desoxydiert zudem primäre und sekundäre Alkohole[5] und wurde zur Zündung des JP-7-Treibstoffes im Triebwerk sowie des Nachbrenners bei der Lockheed SR-71[6] verwendet; aufgrund der chemischen Eigenschaften des Treibstoffes war eine elektrische Zündung nicht möglich, sodass die pyrophore Wirkung zwischen Triethylboran und dem Luftsauerstoff zur Zündung genutzt wird.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j Eintrag zu Triethylboran in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- ↑ a b c Datenblatt Triethylborane, ≥ 95 % bei Sigma-Aldrich, abgerufen am 10. November 2021 (PDF).
- ↑ Joachim Buddrus: Grundlagen Der Organischen Chemie. von Gruyter, 2011, ISBN 978-3-11-024894-4, S. 172.
- ↑ BASF: Alkylborane ( vom 10. September 2012 im Webarchiv archive.today).
- ↑ Erwin Riedel, Ralf Alsfasser, Christoph Janiak und Thomas M. Klapötke: Moderne Anorganische Chemie. von Gruyter, 2007, ISBN 978-3-11-019060-1 (Seite 593 in der Google-Buchsuche).
- ↑ Lockheed SR-71 Blackbird. March Field Air Museum, archiviert vom am 5. Januar 2014; abgerufen am 5. Mai 2009.


